
����Ŀ����֪A��B��C��D�Ƕ�����Ԫ�ص���̬���ʣ�����A�ǻ���ɫ�����嵥�ʣ�C�ڿ����к�����ߣ�D����������壻E��һ����õĽ�����Y��һ�ֳ�����Һ̬���ʣ�Z��Ψһ�Լ��Ե����壻 M��һ�ֺ���ɫ���ж����壻IΪ���ɫ������ˮ�Ĺ��塣�йص�ת����ϵ����ͼ��ʾ����Ӧ����������ȥ����
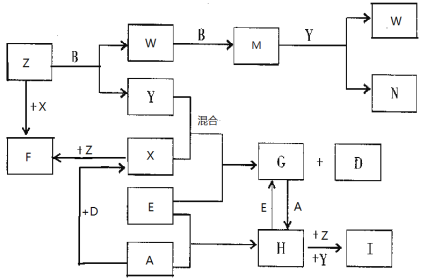
�ش��������⣺
��1��A�����Ԫ����Ԫ�����ڱ���λ��Ϊ ��
��2��F�л�ѧ���������� �� ����ÿ��2�֣���4�֣�
��3��Z��W�ڴ��������·�Ӧ����C��Y������һ������ʵ������ķ�Ӧ����������W�Ի�������Ⱦ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��4��IΪ���ɫ������ˮ�Ĺ��壬�롰84����Һ������Ч�ɷ�(NaClO) ����Ũ����Һ�з�����Ӧ�����˸�Ч�����ľ�ˮ���������ƣ���д���˷�Ӧ�����ӷ���ʽ ��
��5����������E�ӵ�N��ϡ��Һ�У���������ת�Ƶ��ӵ���ĿΪ3.01��1023����μӷ�Ӧ��E������Ϊ
g��
��������1���������ڵ�VIIA��
��2�����Ӽ���(����)���ۼ���
��3��4NH3��6NO![]() 5N2��6H2O��
5N2��6H2O��
��4��2Fe(OH)3 + 3ClO��+4OH��=2FeO42-+3Cl��+5H2O
��5��42
��������
�����������֪A��B��C��D�Ƕ�����Ԫ�ص���̬���ʣ�����A�ǻ���ɫ�����嵥�ʣ����A��������C�ڿ����к�����ߣ���C�ǵ�����D�����������������D���������������������������Ȼ��⣬��X���Ȼ��⡣E��һ����õĽ�������E�����������������������Ȼ�������H���Ȼ������Ȼ���������Ӧ�����Ȼ��������Ȼ�������������Ӧ�����Ȼ�������G���Ȼ�������Y��һ�ֳ�����Һ̬���ʣ���Y��ˮ���Ȼ�������ˮ�õ����ᣬ������Ӧ�����������Ȼ�������Z��Ψһ�Լ��Ե���������Z�ǰ�����������ˮ�Լ��Ȼ�����Ӧ��������������������I������������Ϊ���ɫ������ˮ�Ĺ������������Ȼ��ⷴӦ�����Ȼ�泥���F���Ȼ�李�M��һ�ֺ���ɫ���ж���������M��NO2��������B��Ӧ����ˮ��W��W��B��Ӧ���ɶ�����������˵��B��������W��NO��������������ˮ�õ�NO�����ᣬ��N�����ᡣ
��1��A�����Ԫ������Ԫ�أ���Ԫ�����ڱ���λ��Ϊ�������ڵ�VIIA����
��2��F���Ȼ�泥����л�ѧ�������������Ӽ����ۼ���
��3��Z��W�ڴ��������·�Ӧ����������ˮ���÷�Ӧ�Ļ�ѧ����ʽΪ4NH3��6NO![]() 5N2��6H2O��
5N2��6H2O��
��4�����������롰84����Һ������Ч�ɷ�(NaClO) ����Ũ����Һ�з�����Ӧ�����˸�Ч�����ľ�ˮ���������ƣ��˷�Ӧ�����ӷ���ʽΪ2Fe(OH)3 + 3ClO��+4OH��=2FeO42-+3Cl��+5H2O��
��5�������������ӵ�������ϡ��Һ����������������NO��ˮ����������ת�Ƶ��ӵ���ĿΪ3.01��1023������ʧȥ�ĵ��ӵ����ʵ�����0.5mol�����Բμӷ�Ӧ������0.25mol�������������������0.25mol�����ݵ��ӵ�ʧ�غ��֪����NO��0.5mol��3�����Ը��ݵ�ԭ���غ��֪�μӷ�Ӧ��E������Ϊ��0.25mol��2��0.5mol��3����63g/mol��42g��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������г���һ������NO2��������Ӧ2NO2��g��![]() N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
N2O4��g����H=��57kJmol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯
��������ͼ��ʾ������˵����ȷ���ǣ� ��

A��a��c����ķ�Ӧ���ʣ�a��c
B��a��b�����ת���ʣ�a��b
C��a��c�����������ɫ��a�cdz
D����a�㵽b�㣬�����ü��ȵķ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ������������������ֶ�����Ԫ���е����ֻ�������ɵ�5�ֻ���������ҡ��������������Ԫ����ɣ����ǵ�������ЧӦ����Ҫ���壬������Ȼ������Ҫ�ɷ֣��ҺͶ����������ᷴӦ��������ǿ����Һ��Ӧ������5�ֻ������漰������Ԫ�ص�ԭ������֮�͵���28������һ�ֽ���Ԫ�غ����ַǽ���Ԫ����ɣ���ԭ�Ӹ�����Ϊ1�U3�U9������ԭ����������������н���Ԫ�ص�ԭ������������֮��ķ�Ӧ��ϵ����ͼ��

��ش���������:
��1�����ʼĻ�ѧʽ�� ��д���ҵ�һ����;�� ��
��2����������H2O��Һ��Ӧ�Ļ�ѧ����ʽ ��
��3���������ı�ͨ��ij�����ʵ�ˮ��Һ�п������ɶ����÷�Ӧ�����ӷ���ʽΪ ��
��4��������ijǿ����Һ�����ӷ���ʽΪ ��
��5����200 mL 1.5 mol��L-1NaOH��Һ��ͨ���״����4.48 L �����壬��ȫ��Ӧ��������Һ�У���������Ũ���ɴ�С��˳���� ��
��6������һ���������ʣ����ܶȻ�����Ϊ1.25��10-33����0.01 mol ��Ͷ��1 LijŨ�ȵ������У�Ϊʹ����ȫ�ܽ�õ���������Һ���������Ũ������ӦΪ ������仯���Բ��ƣ����������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪͭ˿��Ũ���ᷴӦ����֤��������ʵ�ʵ��װ�á�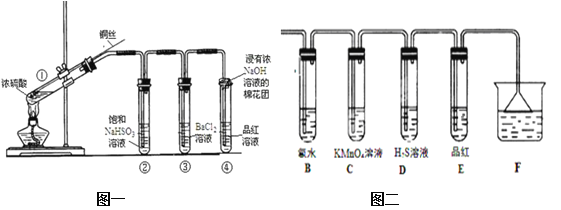
��1�����з�Ӧ�Ļ�ѧ����ʽ�� ������ͭ������ (���������ԭ��)��Ӧ���ж�����Ϊ _______________ ��
��2��Ũ�����ڴ˷�Ӧ��������_________�Ժ�____________�ԡ�
��3�����б���NaHSO3��Һ�������dz�ȥ���лӷ��������ᡣ����һ��ʱ���������Һ��Ȼ���壬������Һ��ɫ����Ҫ������ֹͭ������ķ�Ӧ����ǡ���ķ����� _____________��
a������ͭ˿��ʹ���������� b����ȥ�ƾ��� c����ȥ������������
��4����Ӧֹͣ��װ����ȴ����������Һ����NaOH��Һ���۲쵽��������__________��
��5���������ŵ������� ____ ��
��6������Ũ������ͭ��Ӧ�����������ͨ��ͼ����װ��������Ӧ��װ��B�з����������� ����Ӧ�Ļ�ѧ����ʽΪ ______________________��װ��C�е������� ��������SO2�� �ԣ�װ��D�������� ��������SO2�� ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ʲ����������Ʊ��Ρ����̲����ǵ�ȼ���������һ����Ч���ʲ�������һ�������¿�ת��Ϊ�ʲݴ��ᡣ�����й�˵����ȷ����

A. �ʲ�����ת��Ϊ�ʲݴ�����������ˮ��
B. ��Ni�������£�1mol �ʲݴ����������3molH2�����ӳɷ�Ӧ
C. �ʲ������к����Ȼ����ʻ���̼̼˫�������ǻ��ȹ�����
D. �ʲ����ء��ʲݴ��������Na2CO3����ˮ�����Լ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��2����ѧ�뼼��]
��1���ҹ�ij������̽���̲��зḻ�ij�����(��Ҫ�ɷ�ΪFe2O3��������SiO2������)��ú��ʯ��ʯ����������ڸõ������������������
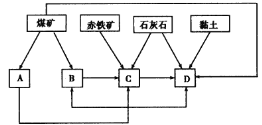
����������Ŀ������������Ľ�������Ҫ�ڸõ�����Ӧ���������������糧��ˮ�೧�ȣ��γɹ�ģ�Ĺ�ҵ��ϵ���ݴ�ȷ��ͼ����Ӧ���������ƣ�A��________��B��________��C��________��D��________��
���Գ�����Ϊԭ�ϣ�д����¯�����еõ������Ͳ���¯���Ļ�ѧ����ʽ��
__________________________________________________________��
��
��2�������ֿ��ɷ�ȩ��֬�Ͳ�����ά�Ƴɡ�
�ٷ�ȩ��֬�ɷ�ȩ�ͼ�ȩ���۶��ɣ���Ӧ�д����ȷų���Ϊ��ֹ�¶ȹ��ߣ�Ӧ���б��ӵķ�Ӧ��________�ؼ����ȩ���ҷ�Ӧ��Ӧװ��________װ�á�
�ڲ������в�����ά��������______�������־��� ���������ܣ�д�����㼴�ɣ���
�����д����Ͼ��ȹ��Է�ȩ���ϵ�������������________��
a������ b�������������֬����
c������ȼ�� d�����л��ܼ������ܽ⣬������֬
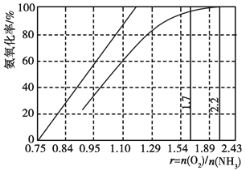
��3����ҵ����Ҫ���ð��������������ᣬ��ͼ�ǰ��������백������������������ȵĹ�ϵ������ֱ�߱�ʾ��Ӧ������ֵ�����߱�ʾ����ʵ����������������ʴﵽ100%��������r[n(O2)/n(NH3)]��________��ʵ������Ҫ��rֵά����1.7��2.2֮�䣬ԭ����___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о���ѧϰС���Լ���Ϊԭ����ʵ���������һ����̼�ͼ���ͭ�������ʵ��Ʊ�ʵ�顣
ʵ��һ���ü����Ʊ�һ����̼
CO���Ʊ�ԭ����HCOOH![]() CO��+H2O���Ʊ�װ������ͼ�����мг���������������û�л�����
CO��+H2O���Ʊ�װ������ͼ�����мг���������������û�л�����
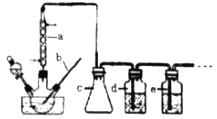
��1��b����������Ϊ___________��c��������___________��
��2���Ʊ�COʱ��Ũ���������Ļ�Ϸ�ʽ��___________��
ʵ������ü����Ʊ�����ͭ[Cu��HCOO��24H2O]
����һ����ʽ̼��ͭ���Ʊ�
�����������ͭ���Ʊ�
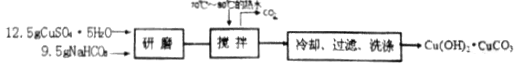
����Ʒ��ʽ̼��ͭ�����ձ��ڣ�����Լ20mL����ˮ�����Ƚ�����323K���ң���μ�������������������ȫ�ܽ⣬���ȹ�������Һ��ͨ�����������ԭ�����![]() ���ң���ȴ�����£���ѹ���ˣ�ϴ�ӣ���Cu��HCOO��24H2O��Ʒ��������������ʡ��ش��������⣺
���ң���ȴ�����£���ѹ���ˣ�ϴ�ӣ���Cu��HCOO��24H2O��Ʒ��������������ʡ��ش��������⣺
��3�����Ʊ���ʽ̼��ͭ�Ĺ����У�����¶ȹ��ߣ��Բ����к�Ӱ�죿___________��
��4��������м�ʽ̼��ͭ�������������ˮ�ϼ���ͭ�Ļ�ѧ����ʽΪ___________��
��5����ʵ���漰���ֹ�Һ����ķ�����
��������ʹ�õ���������___________��
�����ü�ѹ���˵�װ�öԲ��������ܽ�����Һ���г��ȹ�����
����������ʵ���У����õ�����װ��___________

��6�����ճ������õIJ�ƷΪ7.91g�������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�����H2��I2(g)�����ܱ������н��з�Ӧ��H2��I2��g��![]() 2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
2HI����Ӧ���е�2minʱ��÷�Ӧ���ʦԣ�HI��=0.1mol/��L��min����I2(g)�����ʵ���Ũ��Ϊ0.4mol/L��
��1����Ӧ���ʦԣ�I2���� ��
��2��2minδc(HI)�� mol/L��
��3����ʼʱ��c(H2)�� mol/L����Ӧ���е�2minʱ��������I2��ռ�����������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����298K��100kPaʱ.CH4��ȼ������890.0kJ/mol��д���÷�Ӧ���Ȼ�ѧ����ʽ__________������CH4��CO�Ļ������0.75mol����ȫȼ��������CO2�����18gҺ̬ˮ�����ų�QkJ����(�ٶ�����δ��ʧ)����CH4��CO�����ʵ����ı�Ϊ__________��
��2�����ü����ȼ����Ӧ���һ��ȼ�������������������Һ���������Һ.���ʯī���缫���ڵ缫�Ϸֱ�ͨ������������ͨ���������ĵ缫�Ϸ����ĵ缫��Ӧ��___________������·��ת��12mol����ʱ��ʵ���ṩ�ĵ�����890.0kJ����õ�ص�����ת��Ч����__________��
��3����������ʯī������ʢ�б���NaCl��Һ��U�ι����γ���ͼװ�ã�

��������K1�պϣ����������绯ѧ��ʴ�е�__________��ʴ��
��������K2�պϣ����ܷ�Ӧ�����ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com