
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 前三种均有可能 |
分析 可逆反应C(s)+H2O(g)?CO(g)+H2(g)达到平衡时,测得气体的总质量为m g,混合气体的物质的量n mol混合气体平均摩尔质量=$\frac{m}{n}$mol/L,当改变某一条件使平衡向左移动达到新的平衡时,混合气体物质的量的变化值△n=x,且m>12x,n>x,平衡逆向进行,气体物质的量减小为生成水的物质的量,蒸馏减小为生成碳的质量,
C(s)+H2O(g)?CO(g)+H2(g)△n
12 1 1
12x x x
达到新的平衡时,混合气体的平均相对分子质量=$\frac{mg-12xg}{(n-x)mol}$,由此分析解答.
解答 解:可逆反应C(s)+H2O(g)?CO(g)+H2(g)达到平衡时,测得气体的总质量为m g,混合气体的物质的量n mol混合气体平均摩尔质量=$\frac{m}{n}$mol/L,当改变某一条件使平衡向左移动达到新的平衡时,混合气体物质的量的变化值△n=x,且m>12x,n>x,平衡逆向进行,气体物质的量减小为生成水的物质的量,蒸馏减小为生成碳的质量,
C(s)+H2O(g)?CO(g)+H2(g)△n
12 1 1
12x x x
达到新的平衡时,混合气体的平均相对分子质量=$\frac{mg-12xg}{(n-x)mol}$,
①m>12n时,$\frac{mg-12xg}{(n-x)mol}$>$\frac{m}{n}$,则混合气体相对平均分子质量变大;
②m=12n时,$\frac{mg-12xg}{(n-x)mol}$=$\frac{m}{n}$,则混合气体相对平均分子质量不变;
③m<12n时,$\frac{mg-12xg}{(n-x)mol}$<$\frac{m}{n}$,则混合气体相对平均分子质量减小;
故选D.
点评 本题考查了化学平衡气体平均摩尔质量的计算分析判断,注意反应中碳为固体,平衡发生移动,气体质量和物质的量都发生变化,掌握基础是解答关键,题目难度中等.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 946 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 1130 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
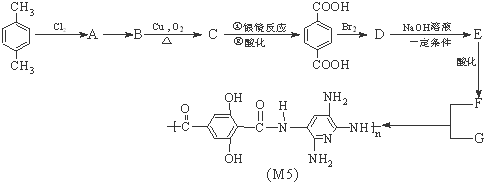
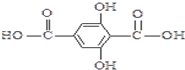 .
.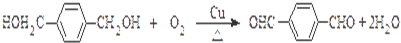 ,
,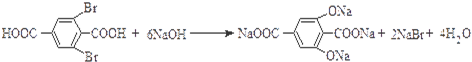 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 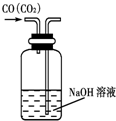 除去CO气体中的CO2气体 | B. | 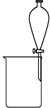 分 分离碘酒中的碘和酒精 | ||
| C. | 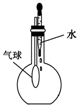 验证NH3的溶解性 | D. | 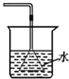 吸收HCl防倒吸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
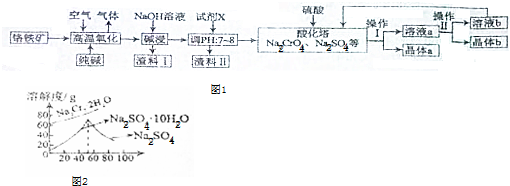
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
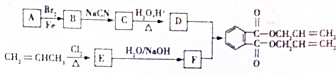
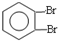 ,化合物E中所含的官能团名称为氯原子、碳碳双键.
,化合物E中所含的官能团名称为氯原子、碳碳双键.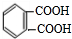 +2HOCH2CH=CH2$\stackrel{催化剂}{→}$
+2HOCH2CH=CH2$\stackrel{催化剂}{→}$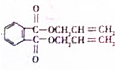 +2H2O,反应类型为酯化(取代)反应.
+2H2O,反应类型为酯化(取代)反应.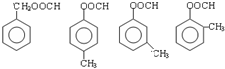 (其中一种).
(其中一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2、NO2和CO2都是污染性气体 | |
| B. | 熟石灰、铝热剂、盐酸都是混合物 | |
| C. | 煤的干馏、海水中提取碘的过程都包括化学变化 | |
| D. | A12O3、Cl2、CuSO4在熔融状态或溶于水时均能导电,都属电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com