
| A. | 2H2(g)+O2(g)═2H2O (l)△H=-285.8 kJ•mol-1 | |
| B. | 2H2(g)+O2(g)═2H2O (l)△H=+571.6 kJ•mol-1 | |
| C. | 2H2(g)+O2(g)═2H2O (g)△H=-571.6 kJ•mol-1 | |
| D. | H2(g)+1/2O2(g)═H2O (l)△H=-285.8 kJ•mol-1 |
科目:高中化学 来源: 题型:选择题
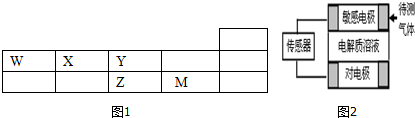
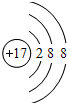
| A. | 元素Z可与元素X形成共价化合物XZ2 | |
| B. | 元素X与W形成的原子个数比为1:1的化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间(min) 物质的量(mol) | 0 | 1 | 2 | 3 | 4 |
| X2 | 3.0 | n1 | 2.4 | n3 | n5 |
| H2 | 9.0 | 8.4 | 7.2 | n4 | n6 |
| XH3 | 0 | 0.4 | n2 | 2.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | NaOH/mol•L-1 | HA/mol•L-1 | 混合溶液的pH |
| ① | 0.1 | 0.1 | pH=9 |
| ② | C | 0.2 | pH=7 |
| ③ | 0.1 | 0.2 | pH<7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 萘(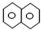 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种 | |
| B. | 酚酞的结构如图所示,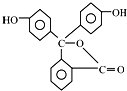 其结构中含有羟基(-OH),故酚酞属于醇 其结构中含有羟基(-OH),故酚酞属于醇 | |
| C. | 溴水能将甲苯、己烯、CCl4、乙醇四种溶液鉴别开来 | |
| D. | 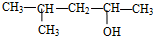 的名称为2-甲基-4-戊醇 的名称为2-甲基-4-戊醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
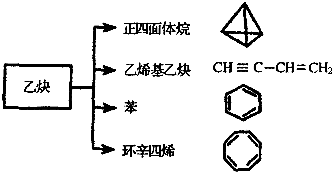 乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物.
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下(如图)化合物. .
. 、
、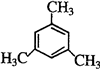 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com