
| A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中 |
| B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出 |
| C.从碘水中提取单质碘时,不能用无水乙醇代替CCl4 |
| D.检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCl2溶液和稀盐酸 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 取酸雨试样,加入10%H2O2溶液,再加入BaCl2溶液,有白色沉淀 | 该酸雨试样中一定含有H2SO3 |
| B | 在有镀层的铁片上,用刀刻一槽,在槽上滴入少量0.1mol/L盐酸,2h后滴入KSCN溶液,无红色出现 | 可能是镀锡的铁片 |
| C | 配制SnCl2溶液时,先将SnCl2溶于适量稀盐酸,再用蒸馏水稀释,最后在试剂瓶中加入少量的锡粒 | 抑制Sn2+水解,并防止Sn2+被氧化为Sn4+ |
| D | 某无色溶液,加银氨溶液,水浴加热,有银镜生成 | 溶液中一定含醛类化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.鉴别氯化钠和氯化钾,用焰色反应 | B.用激光笔鉴别氢氧化铁胶体和氯化铁溶液 |
| C.用酒精萃取溴水中的溴 | D.用湿润的红色石蕊试纸,检验氨气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | NaOH起始读数 | NaOH终点读数 |
| 第一次 | 0.40mL | 18.50mL |
| 第二次 | 1.30mL | 18.05mL |
| 第三次 | 3.10mL | 21.20mL |
 色到 色;
色到 色;| A.滴定终点读数时,俯视滴定管的刻度,其它操作均正确 |
| B.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 |
| C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
| D.未用标准液润洗碱式滴定管 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用酸性KMnO4溶液鉴别乙烯和乙炔 | B.将乙烷与溴水混合光照制溴乙烷 |
| C.苯和硝基苯的混合物采用分液的方法分离 | D.可用CCl4萃取碘水中的碘 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 中氨的催化氧化,回答下列问题:
中氨的催化氧化,回答下列问题: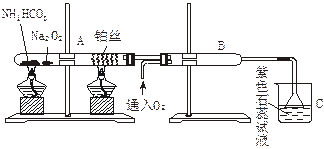
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
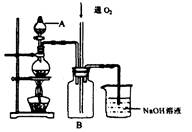
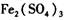 作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节
作催化剂加人到铜粉与稀硫酸的混合物中,并通人空气或氧气,即发生反应。反应完全后向其中加人物质甲调节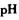 ,产生
,产生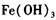 沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作
沉淀,过滤、蒸发、结晶,得到硫酸铜晶体,滤渣作 催化剂循环使用。
催化剂循环使用。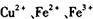 分别生成沉淀的pH如下:
分别生成沉淀的pH如下:| 物质 | 开始沉淀时的PH | 完全沉淀时的PH |
| Fe(OH)3 | 1.9 | 3. 2 |
| Cu(OH)2 | 4. 7 | 6. 7 |
| Fe(OH)2 | 6. 3 | 9. 7 |
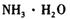 b.
b.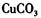 c.
c.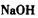 d.
d.
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
|
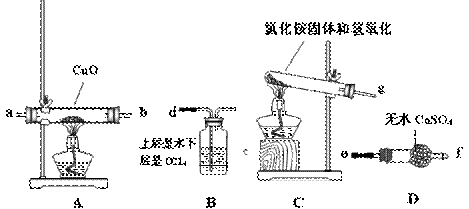 ①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )
①请你根据提供的装置从左至右连接接口序号( )()( )( )( )( )查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com