
分析 水的电离过程为H2O?H++OH-,无论在什么温度下,纯水永远显中性;c(OH-)=c(H+),100℃时,水的离子积为10-12,保持100℃恒温,根据Kw=c(OH-).c(H+)计算盐酸溶液中C(H+)氢氧化钠溶液中氢氧根离子浓度,依据H++OH-=H2O,分析溶液中氢离子和氢氧根离子反应后剩余的离子,据此计算再根据pH=-lgc(H+)计算出溶液的pH.
解答 解:c(OH-)=c(H+),100℃时,水的离子积为10-12,保持100℃恒温,根据Kw=c(OH-).c(H+)计算盐酸溶液中C(H+)=10-2mol/L,氢氧化钠溶液中氢氧根离子浓度c(OH-)=$\frac{1{0}^{-12}}{1{0}^{-11}}$=0.1mol/L,依据H++OH-=H2O氢氧根离子剩余,剩余氢氧根离子浓度c(OH-)=$\frac{0.1mol/L×0.1L-0.01mol/L×0.1L}{0.2L}$=4,5×10-2mol/L,
C(H+)=$\frac{1{0}^{-12}}{4.5×1{0}^{-2}}$mol/L≈2×10-11mol/L,PH=-lg2×10-11=10.7,
答:混合溶液的pH值为10.7.
点评 本题考查了溶液PH计算,主要是酸碱反应后溶液中的离子浓度计算和PH计算,注意离子积常数随温度变化,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 同一周期原子半径从左到右依次减小 | |
| B. | 同一主族元素的化学性质相同 | |
| C. | 同一周期元素最高化合价从左到右不一定增大 | |
| D. | 同一主族元素的化学性质相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
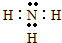
 ,其中含有的化学键有共价键、离子键,属于离子 晶体
,其中含有的化学键有共价键、离子键,属于离子 晶体查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向30mL0.1mol•L-1NaOH溶液滴加20mL0.1mol•L-1H2C2O4溶液后:3c(Na+)=2[c(HC2O${\;}_{4}^{-}$)+c(C2O${\;}_{4}^{2-}$)+c(H2C2O4)] | |
| B. | 将同浓度的CH3COONa溶液和HCl溶液按照体积比2:1混合,混合后溶液呈酸性:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) | |
| C. | 向NH4HSO4溶液中加入NaOH至中性:c(Na+)>c(SO${\;}_{4}^{2-}$)═c(NH${\;}_{4}^{+}$) | |
| D. | 常温下将pH为3的CH3COOH溶液与pH为11的NaOH溶液等体积混合,所得溶液中:c(OH-)=c(H+)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,0.1mol•L-1的CH3COOH溶液中,由水电离出的c(H+)为1.0×10-13mol•L-1 | |
| B. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| C. | 常温下,等体积pH=12的NaOH溶液和pH=2的CH3COOH溶液混合,混合后溶液的pH<7 | |
| D. | 25℃时,完全中和50mLpH=3的H2SO4溶液,需要pH=11的NaOH溶液50mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1某一元弱酸(HA)溶液中:c2(H+)=c(H+)•c(A-)+Kw | |
| B. | 已知Ka(HNO2)=4.6×10-4,Kb(NH3•H2O)=1.8×10-5,可推断NH4NO3溶液呈碱性 | |
| C. | 25℃时,现向10mL浓度为0.1mol•L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$先增大后减小 | |
| D. | NH4Cl溶液中滴加NaOH溶液至溶液呈中性时,则有c(Na+)>c(NH3•H2O) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a>b | B. | a<b | C. | a=b | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
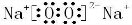 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com