
 ⑥
⑥ ⑤
⑤
分析 (1)含有苯环的烃属于芳香烃,且在元素组成上只含有C、H两种元素,据此判断;
(2)结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称为同系物,据此判断;
(3)同分异构体是分子式相同结构式不同的化合物;
(4)根据烯烃的命名原则对该有机物进行命名:
a.选择的主链必须包括碳碳双键,按主链碳原子数称为某烯.如 果主链碳原子数超过 10,则称为某碳烯;
b.从靠近双键的一端对主链碳原子编号,并以双键碳原子中编号较小的数字表示双键的位次,写在烯烃名.
解答 解:(1) 含有苯环,且在元素组成上只含有C、H两种元素,属于芳香烃,
含有苯环,且在元素组成上只含有C、H两种元素,属于芳香烃,
故答案为:⑥;
(2)CH≡CH和CH3C≡CCH3结构相似,在分子组成上相差2个CH2原子团,互为同系物;
故答案为:①;
(3)CH3CH=CHCH3和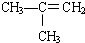 的分子式相同,结构不同,属于同分异构体;
的分子式相同,结构不同,属于同分异构体;
故答案为:②;
(4)CH3CH=CHCH3主链有4个碳原子,名称为2-丁烯,故答案为:2-丁烯.
点评 本题主要考查了同系物、同分异构体、烃的衍生物和烯烃的命名等,难度不大,注意应从距离官能团最近的一端开始编号.


科目:高中化学 来源: 题型:选择题
| A. | ClO3-的空间构型为平面三角形 | |
| B. | SiF4 和 SO32-的中心原子均为 sp3 杂化 | |
| C. | 在所有的元素中,氟的第一电离能最大 | |
| D. | C2H5OH 分子中共含有 8 个极性键,1 个 π 键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
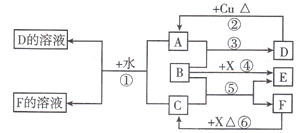
 .根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).
.根据图中信息,B、C、X的氧化性由强到弱的顺序是MnO2>Cl2>H2O2(用化学式表示).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17 g氨气含有的原子总数为NA | |
| B. | 2.4 g金属镁与氧气完全反应时失去的电子数为0.1 NA | |
| C. | 常温常压下,6.4 g二氧化硫气体所含的氧原子数为0.2 NA | |
| D. | 常温常压下,11.2 L氯气含有的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀盐酸反应2Fe+6H+═2Fe3++3H2↑ | |
| B. | 盐酸中加入碳酸钙CO32-+2H+═H2O+CO2↑ | |
| C. | CO2通入足量澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | NaHCO3溶液中加入盐酸CO32-+2H+═H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )
工业合成氨原理N2(g)+3H2(g)?2NH3(g)△H<0.在一定条件下达化学平衡后,在t时突然改变条件,反应速率的变化如右图所示,则t时所改变的条件是( )| A. | 增大压强 | B. | 降低温度 | C. | 升高温度 | D. | 分离出氨气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com