
A.离子键 B.共价键 C.非极性键 D.极性键
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:阅读理解
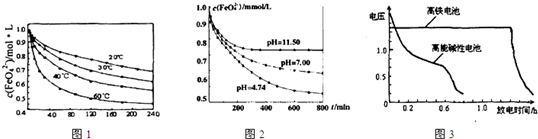
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① | ② | |||||||||
| A | 硫酸氢钠与氢氧化钠溶液反应: HSO4-+OH-=H2O+SO42- |
向KHSO4溶液中滴入Ba(OH)2溶液使pH=7: SO42-+2H++Ba2++2OH-=BaSO4↓+2H2O | ||||||||
| B | K2Cr2O7在水中存在平衡:Cr2
可由溶液颜色判断其酸碱性 |
酸性高锰酸钾可使草酸溶液褪色,其离子方程式为:2Mn
| ||||||||
| C | H2S气体通入FeCl3溶液中: 2Fe3++H2S=2Fe2++S↓+2H+ |
S2
| ||||||||
| D | FeBr2中通入过量Cl2: 2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- |
SOCl2是一种液态化合物,遇水有雾及刺激性气味气体产生,其化学反应方程式为:SOCl2+H2O=2HCl↑+SO2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com