
����Ŀ����ҵ�Ƶõĵ�������AlN����Ʒ�г���������Al4C3��Al2O3��C�����ʡ�ijͬѧ�������ʵ��ֱ�ⶨ��������AlN����Ʒ��AlN��Al4C3����������������NH3��ǿ������Һ�е��ܽ⣩��
��1��ʵ��ԭ����
��Al4C3�����ᷴӦ������CH4��
��AIN����ǿ�������Σ�����ǿ�����ɰ�������д��AlN��NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��__________________________________________________________________
��2��ʵ��װ�ã���ͼ��ʾ��������Ϊ��ʽ�ζ��ܸ�װ��
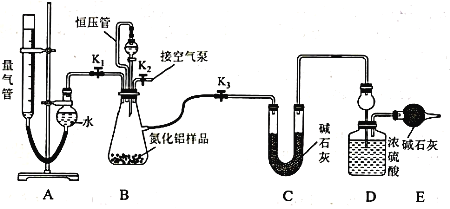
����װ�ú�����Ӧ���еIJ�����_____________________________________ ��
��3��ʵ����̣��Ƶ�װ��D�ij�ʼ����Ϊy g����ȡx g AlN��Ʒ����װ��B��ƿ�У���װ���м�����ӦҩƷ����������װ�ã���ȡ�����ܵij�ʼ����Ϊa mL(����װ������Һ����ƽ)��
�������Ȳ���Al4C3�����������й����ݣ���K1��K2��K3���������IJ����ǹرջ���_______������______��
������ѹ�ܣ����������������Ӱ����_______���ƫ����ƫС������Ӱ�족����
����������Һ�治�ٷ����仯��˵����Ӧ�Ѿ���������ȡ����֮ǰ��Ӧ�������ܽ��еIJ���Ϊ ______________________________________ �����������е�Һ������Ҳ����������е�Һ�棬������������_________���ƫ����ƫС������Ӱ�족����
�ܼ�¼�ζ��ܵĶ���Ϊb mL����֪����ʵ�������µ�����Ħ�����ΪVm L�� mol��1������Al4C3����������Ϊ___________���ÿ��ܺ�a��b��x��y��Vm�Ĵ���ʽ��ʾ����
�ݲ���AlN�������������ݣ����ȹرջ���K1������K3��ͨ����Һ©���������NaOH��Һ����װ��Bƿ�����ʳ�ַ�Ӧ����Ӧ��ɺ�___________________________����ò�Ӧ���еIJ����������Ƶ�װ��D������Ϊz g��
���𰸡�AlN+NaOH+H2O=NaAlO2+NH3�� ���װ�õ������� K2��K3 K1 ƫ�� ���������ܸ߶ȣ�ʹ��������Һ����ƽ ƫС ![]() ��K2��ͨ��һ��ʱ�����
��K2��ͨ��һ��ʱ�����
��������
������һ���ۺ��⣬��Ҫ������ʵ���Լ���ѧ��Ӧ����ѧ������������Ҫͨ���������ɵ��������������Ʒ�Ĵ��ȣ��ݴ��������Ѷ�һ�㡣
��1��![]() �е���Ԫ����+3�۵ģ�����ڼ��Ի����л�ת��Ϊ
�е���Ԫ����+3�۵ģ�����ڼ��Ի����л�ת��Ϊ![]() �����������Ϣ��֪����һ�ֲ����ǰ������ݴ�д������ʽ���ɣ�
�����������Ϣ��֪����һ�ֲ����ǰ������ݴ�д������ʽ���ɣ�![]() ��
��
��2���ڽ����漰�������ʵ��ʱ����װ��������һ��Ҫ�ȼ���������ٿ�ʼʵ�飬��������ʵ����������ʵ��ʧ�ܣ�
��3���ٸ������⣬��Ҫ֪��![]() ����������������Ҫ���
����������������Ҫ���![]() �����ᷴӦ���ɵ�
�����ᷴӦ���ɵ�![]() ������������Ҫʹ��װ��A�е������ܣ��������Ҫ�ȴ�K1���ر�K2��K3�������ɵĴ�
������������Ҫʹ��װ��A�е������ܣ��������Ҫ�ȴ�K1���ر�K2��K3�������ɵĴ�![]() �����������У�
������������
�ڷ�Һ©���ϵĺ�ѹ����ƽ��ѹǿ�����ã�����ѹ�ܣ�����B�е���Һ�ὫB�еĿ������ϡ��������ܣ�����������������ƫ��
���ڶ�ȡ����ǰһ��Ҫ�ȵ��������ܸ߶ȣ�ʹ��������Һ����ƽ�����Dz���������ʱ�Ļ���Ҫ������������Һ������Ҳ����������е�Һ�棬Ҳ����˵�Ҳ��ѹǿ�����в��ִ���������δ������������ܣ����²���������ƫС��
��ʵ���в����ļ������һ����![]() mL����ʵ��������Ϊ
mL����ʵ��������Ϊ![]() mol���飬�ɷ���ʽ��֪
mol���飬�ɷ���ʽ��֪![]() ��
��![]() �Ļ�ѧ������֮��Ϊ3:1����ԭ��Ʒ����
�Ļ�ѧ������֮��Ϊ3:1����ԭ��Ʒ����![]() mol
mol ![]() ��
��![]() ��Ħ������Ϊ144g/mol�����ԭ��Ʒ����
��Ħ������Ϊ144g/mol�����ԭ��Ʒ����![]() g
g![]() ����
����![]() ����������Ϊ
����������Ϊ![]() �������Ϊ
�������Ϊ![]() ��
��
��K2���������ڣ���Ӧ�������Ի�����������������װ��B�ڣ����ǿ��Դ�K2����ӿ����ã�ͨ�������װ��B�ڵİ������ϡ���װ��D�У�ȷ�����еİ�������D���գ��������Ҫ�����ǣ���K2��ͨ��һ��ʱ��Ŀ�����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�һ�����ܱ������У�����һ������ NO(g)������C(s)��������Ӧ C(s)��2NO(g)![]() CO2(g)��N2(g)��ƽ��״̬ʱ NO(g)�����ʵ���Ũ�� c(NO)���¶� T �Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����( )
CO2(g)��N2(g)��ƽ��״̬ʱ NO(g)�����ʵ���Ũ�� c(NO)���¶� T �Ĺ�ϵ��ͼ��ʾ��������˵������ȷ����( )
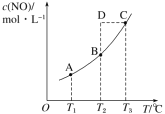
A.�÷�Ӧ�� ��H>0B.���÷�Ӧ�� T1��T2 ʱ��ƽ�ⳣ���ֱ�Ϊ K1��K2���� K1<K2
C.�� T3 ʱ�������������ܶȲ��ٱ仯��������жϷ�Ӧ�ﵽƽ��״̬ CD.�� T2 ʱ������Ӧ��ϵ����״̬D�����ʱһ���� v ��<v ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2A�Ƕ�Ԫ���ᣬ25��ʱ������һ��c(H2A)��c(HA��)��c(A2��)��0.1mol��L-1��H2A��NaOH�����Һ����Һ��H2A��HA����A2����ռ�����������������ʵ�����������������ҺpH�仯�Ĺ�ϵ��ͼ��ʾ������˵����ȷ����
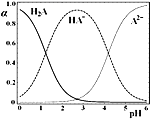
A.c(Na��)��0.1mol��L-1����Һ�У�c(H��)��c(A2��)��c(OH��)��c(H2A)
B.c (HA��)��c(A2��)����Һ�У�c(Na��)��3c(A2��)
C.c (HA��)��0.5mol��L-1����Һ�У�2c(H2A)��c(H��)��c(OH��)��1.5mol��L-1
D.pH��2����Һ�У�c(HA��)��2c(A2��)��0.1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ[xCuO��yCuCl2��zH2O]��ũҵ������ɱ��������ҵ����ͭ��ۣ���Ҫ��Cu2(OH)2CO3��Fe3O4�ȣ�Ϊԭ����ȡ������ͭ���������£�

�š�����pH��������Fe(OH)3ʱ��Ӧ�����ӷ���ʽΪ______��
�Ƶ���pH��Ҫʹ������Һ��c(Cu2��)��0.022mol��L-1����c(Fe3��)��1��10��6mol��L-1����Ӧ����pH�ķ�ΧΪ______������֪Ksp[Cu(OH)2��2.2��10��20]��Ksp[Fe(OH)3��1��10��36]��
��Ϊ�ⶨ������ͭ����ɣ��ֽ�������ʵ�飺
�����ȡ0.4470 g������ͭ��������ƿ������һ����30%������ʹ������ȫ�ܽ⡣�μ�K2CrO4��Һ��ָʾ������0.1000mol��L��1 AgNO3����Һ�ζ���Һ�е�Cl�����ζ����յ�ʱ����AgNO3����Һ20.00 mL��
�����ȡ0.4470g������ͭ��������ƿ������һ��������ʹ������ȫ�ܽ⡣����Һ�м��������KI���壬��ַ�Ӧ������Һ�е������ε�����Һ����0.2000mol��L��1Na2S2O3����Һ�ζ����ζ����յ�ʱ����Na2S2O3����Һ20.00mL��
��֪��������������ķ�Ӧ���£�
2Cu2+��4I����2CuI����I2 2Na2S2O3��I2��2NaI��Na2S4O6
����֪Ag2CrO4Ϊש��ɫ�����������ζ��յ�ʱ��ʵ��������_______��
��ͨ������ȷ��������ͭ�Ļ�ѧʽ________________��д��������̣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС����ʵ�������Ҵ���Ũ������廯�ƺ�ˮ��Ϸ�Ӧ���Ʊ������飬��̽������������ʡ��й����ݼ��±���
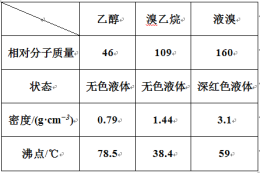
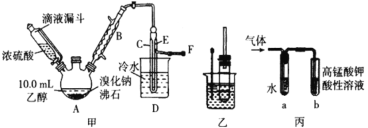
I. ��������Ʊ�
��Ӧԭ�����£�ʵ��װ������ͼ������װ�á��г�װ�þ�ʡ�ԣ���
H2SO4+NaBr ![]() NaHSO4+HBr�� CH3CH2OH+HBr
NaHSO4+HBr�� CH3CH2OH+HBr ![]() CH3CH2Br+H2O
CH3CH2Br+H2O
��1�� ͼ����A ����������_____��ͼ��B �����ܵ�����Ϊ_____��
��2�� ��ͼ����A �����¶ȹ���Ũ�����Ũ�ȹ�����ʹ C ���ռ����Ĵֲ�Ʒ�ʳ�ɫ��ԭ����A �з����˸���Ӧ������_____��F ���ӵ���ͨ��ϡNaOH ��Һ�У���Ŀ����Ҫ������_____��β����ֹ��Ⱦ����
II. ���������ʵ�̽��
����ͼʵ��װ����֤����������ʣ�
��3�� �������Թ��ڼ��� 10mL6mol��L ��1NaOH ��Һ�� 2mL �����飬�����ã�Һ��ֲ㣬ˮԡ���ȡ��ù����еĻ�ѧ����ʽΪ_______��
��4�� ���������Թ���� NaOH ��Һ����NaOH �Ҵ���Һ��Ϊ֤������Ϊ��ϩ�������ɵ�����ͨ����ͼ��װ�á�a �Թ��е�ˮ��������_______������ a �Թܣ������ɵ�����ֱ��ͨ�� b �Թ��У��� b�е��Լ�����Ϊ _____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��KMnO4��ʵ���ҡ������ѧ�о�����ҵ�������й㷺��Ӧ�á���֪һ���Ʊ�KMnO4��ʵ�����̡�ԭ��������������£�

ԭ������ӦI��3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
��Ӧ��3K2MnO4+2CO2=2KMnO4+MnO2��+2K2CO3
(ī��ɫ) (�Ϻ�ɫ)
��֪��25�����ʵ��ܽ��g/100gˮ
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)����ڵĸ���Ӧ�����������������ɣ��÷�Ӧ�Ļ�ѧ����ʽΪ___________��
(2)�������CO2______(��ܡ�������)������ԭ����_____________��
(3)�����п�ѭ�����õ�������Ҫ��_________(д��ѧʽ)��
(4)���Ա������к������ʵ�ѭ�����ã�������0.3mol MnO2���õ���ƷKMnO4������Ϊ________g��ijͬѧ��ʵ���еõ������Ʒ��������������ֵ���ų��������أ��Ӳ���߷��������ܵ�ԭ����_______________��
(5)�����Ƶζ�������������ش��Ȳ������£�
��.��ȡ1.5800g������ز�Ʒ�����100mL��Һ
��.ȷ��ȡ����0.5360g�Ѻ�ɵ�Na2C2O4������������ͬ�Ľྻ��ƿ�У��ֱ������������ˮʹ���ܽ⣬�ټ������������ữ��
��.��ƿ����Һ���ȵ�75��80�棬������I�����Ƶĸ��������Һ�ζ����յ㡣��¼ʵ���������
ʵ����� | V1(�ζ�ǰ����/mL) | V2(�ζ������/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
��֪��2MnO4��+ 5C2O42��+16H+ =2Mn/span>2++ 10CO2��+ 8H2O����KMnO4�Ĵ���Ϊ__________(������λ��Ч����)�����ζ����ӵζ��ܶ���������KMnO4�Ĵ��Ƚ�___(�ƫ�ߡ���ƫ�͡�����Ӱ�족)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ά�ǹ��Ҹո���������ҩ�������з硢�ļ����������ಡ���ߴ�������������ά�����������Σ����Ľṹ��ͼ��ʾ�����й�������˵����ȷ���ǣ���
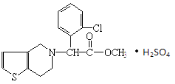
A.�����ʵĻ�ѧʽΪC16H15ClNO2��H2SO4
B.1mol������������6mol������Ӧ
C.����ά���γ���������������ṹ�еĵ�ԭ���й�
D.���л�����Է�����������ԭ���ӳɡ�ȡ������ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֱ����뷴Ӧ����ʽ��Ӧ����ȷ���ǣ�������
A.��������������Fe2O3��6H��===2Fe3����3H2O
B.�������ʵ�����KHCO3��Ba(OH)2��Һ��ϣ�HCO3-��Ba2����OH��===BaCO3����H2O
C.���Ȼ�����Һ�м��������ˮ��Al3+��4NH3��H2O=== AlO2-��4NH4+��2H2O
D.��Ca(ClO)2��Һ��ͨ������SO2��Ca2++2ClO-+SO2+H2O![]() CaSO3��+2HClO
CaSO3��+2HClO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������װ��������ʵ�飬���������ǣ�������
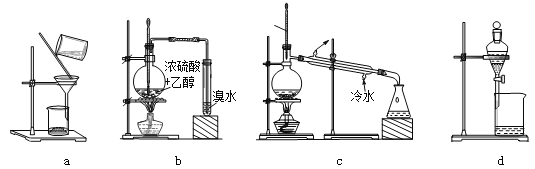
A. ��a���ȹ����ᴿ������B. ��b�Ʊ���������ϩ
C. ��c��ȥ�屽�еı�D. ��d������������ˮ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com