
【题目】乙烯是石油化工的重要原料,它主要通过石油产品裂解获得。
(1)石油产品裂解所得裂解气的平均组成可表示为CnHm(m>2n),经测定某裂解气中各气体的体积分数分别为:甲烷―4%、乙烯―50%、丙烯―10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到50 mol乙烯,x mol丁二烯和y mol氢气。则x+y= , n / m = (请用含x的式子表示)。(4分)
(2)某化工厂每天由石油产品裂解得到乙烯56 t。再以乙烯为主要原料生产醋酸乙烯酯,醋酸乙烯酯是合成维尼纶的重要单体。生产原理如下:

反应①中乙烯的利用率为80%,反应②中乙醛的利用率为83.33%,反应③中乙酸与乙烯的利用率均为85%。则该厂每天最多可制得醋酸乙烯酯多少吨?(8分)
【答案】(1)36,(67+2X)/(174+2X) ;(2)58.5 t
【解析】
试题分析:(1)体积分数等于物质的量的体积分数,得到50mol乙烯,因此裂解气的总物质的量为50/50%=100mol,丁二烯和氢气的总物质的量为100×(1-4%-50%-10%)mol=36mol,即x+y=36mol,n(CH4)=100×4%=4mol,n(C2H4)=100×50%mol=50mol,n(C3H6)=100×10%=10mol,n(C4H6)=xmol,则n(H2)=(36-x)mol,则n=(4+50×2+10×3+4x)mol,m=[4×4+50×4+10×6+6x+(36-x)×2]mol,n/m=(67+2x)/(174+2x);(2)设转化成乙酸的乙烯物质的量为xmol,则生成乙酸的量为x×80%×83.3%mol,设与乙酸反应的乙烯物质的量为ymol,根据反应③有为x×80%×83.3%×85%=y×85%,整理得,2x=3y,根据反应③有CH2=CH2~CH3COOCH=CH2
28 86
56×2×85%/5 m(CH3COOCH=CH2) 则m(CH3COOCH=CH2)=58.5t。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关,下列有关说法正确的是( )
A.维生素C具有还原性,在人体内起抗氧化作用
B.淀粉、油脂和蛋白质都是高分子化合物
C.雾霾、温室效应、光化学烟雾的形成都与氮的氧化物有关
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为氧化铝,含少量氧化铁)制取铝的过程如图所示:
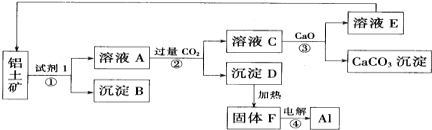
(1)试剂1为______(填化学式),①~④转化过程中_____消耗能量最多。
(2)沉淀B的化学式为______。
(3)电解F,当转移6mol电子时,可制得铝______ g。
(4)生产过程中,除物质E可以循环使用外,还可以循环使用的物质有______(填化学式)。
(5)写出离子方程式:①______, ② ______。
(6)写出化学方程式:④______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO)。向反应后的溶液中加人3 mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g。则下列叙述中不正确的是 ( )
A.当生成的沉淀量达到最大时,消耗NaOH溶液的体积V≥100 mI。
B.当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
C.参加反应的金属的总质量为9.6 g>m>3.6 g
D.当金属全部溶解时收集到NO气体的体积一定为2. 24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物由C、H、O三种元素组成,分子中含有8个原子,1mol该有机物含有46mol质子.完全燃烧该有机物在相同条件下测定CO2和水蒸气体积比为2:1。取2.7g该有机物恰好与30mL 1mol/L的碳酸钠溶液完全反应。(请写出必要的计算过程)求:
(1)有机物分子式;
(2)有机物结构简式.
(3)写出该有机物在一定条件下与乙二醇反应生成六元环状化合物的方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)肼(N2H4)又称联氨,是一种可燃性液体,可用作火箭燃料。已知在101 kPa,320 g N2H4在氧气中完全燃烧生成氮气,放出热量624 kJ(25 ℃时),N2H4完全燃烧的热化学方程式是:
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20~30%的KOH溶液。肼—空气燃料电池放电时,正极的电极反应式是 ;负极的电极反应式是 。
(3)如图是一个电化学过程示意图。
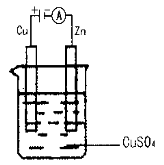
假设使用肼—空气燃料电池作为本过程的电源,铜片质量变化128 g,则肼—空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气的体积含量为20%)。
(4)传统制备肼的方法是以NaClO氧化NH3制得肼的稀溶液,该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了减少城市空气污染,要求使用无铅汽油,所谓无铅汽油是指( )
A.不用铅桶装的汽油
B.不含四乙基铅的汽油
C.不含Pb(NO3)2的汽油
D.不含氧化铅的汽油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用右图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁屑、稀硫酸、氢氧化钠溶液。
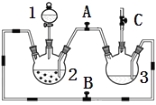
(1)稀硫酸应放在 中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关 、打开开关 就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是 。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备摩尔盐晶体[(NH4)2SO4·FeSO4·6H2O] (相对分子质量392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次来 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52[ | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为
滴定终点的现象是
通过实验数据计算的该产品纯度为 (用字母ac表示).上表中第一次实验中记录数据明显大于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com