
已知X、Y中含有相同的元素,Z、W中也含有相同的元素,根据反应X+H2O Y+H2
Y+H2 ↑;Z+H2O
↑;Z+H2O W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
W+O2↑(方程式均未配平),可推断X、Y中及Z、W中相同元素的化合价的高低顺序为( )
| A.X>Y Z>W | B.X<Y Z<W |
| C.X>Y Z<W | D.X<Y Z>W |
科目:高中化学 来源: 题型:单选题
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06 g Na2CO3和0.84 g NaHCO3,A、B中分别有10 mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )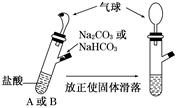
A.A装置的气球膨胀速率大
B.若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L
C.若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L
D.最终两试管中Na+、Cl-的物质的量一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
| A.2∶3 | B.1∶6 | C.3∶2 | D.1∶1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是( )
| A.干燥的氯气可以用钢瓶运输 |
| B.钠可以保存在CCl4液体中(已知:密度CCl4 > Na) |
| C.Na2O2可作为潜水艇的供氧剂 |
| D.实验后剩余的钠粒可放回原试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某同学通过系列实验探究Mg及其化合物的性质, 操作正确且能达到目的的是
操作正确且能达到目的的是
| A.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| B.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| C.将Mg(OH)2浊液直接倒入已装好滤纸的漏斗中过滤,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将ag镁铝合金投入到x mL 2mol/L的盐酸中,金属完全溶解后,再加入y mL 1mol/L的氢氧化钠溶液,得到的沉淀量最大,质量为(a+1.7)g。下列说法不正确的是
| A.镁铝合金与盐酸反应转移电子总数为0.lNA | B.x=2y |
| C.沉淀是Mg(OH)2和Al(OH)3的混合物 | D.2x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
美国“海狼”潜艇上的核反应堆内使用了液体铝钠合金(单质钠和单质铝熔合而成)作载热介质,有关说法不正确的是
| A.合金的熔点一般比组分金属低 |
| B.铝钠合金若投入一定量的水中可得无色溶液,则n(Al)≤n(Na) |
| C.铝钠合金投入到足量氯化铜溶液中,会有氢氧化铜沉淀也可能有铜析出 |
| D.若m g不同组成的铝钠合金投入足量盐酸中,放出的H2越多,则铝的质量分数越小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
Cu(NO3)2是重要的化工原料。回答下列工业生产和化学实验中的几个问题。
(1)实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu  Cu(NO3)2 乙:Cu
Cu(NO3)2 乙:Cu 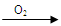 CuO
CuO 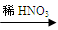 Cu(NO3)2
Cu(NO3)2
①从绿色化学的角度分析, 同学的方案更合理,此同学可节约2mol/L的稀硝酸 mL;
②乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择
方案(填字母序号)。
③有下述装置(如下图),当装置电路中通过2mol电子时,Cu电极(填编号) 。
(a)增重64g (b)减重64g (c)可能增重64g,也可能减重64g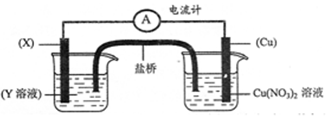
(2)①某校化学兴趣小组的同学对硝酸铜的受热分解进行探究。他们设计了如下图装置加热Cu(NO3)2固体(加热及夹持装置未画出)。加热过程发现:装置①中的固体逐渐变为黑色;装置②中有气泡产生,但在上升的过程中消失;石蕊试液逐渐变为红色,液体几乎不被压至装置③中。请写出Cu(NO3)2受热分解的化学方程式: ;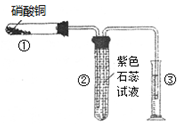
②在装置中①试管的橡皮塞最好用锡箔包住,原因是 。
(3)NO2、O2和熔融NaNO3可制作燃料电池,其原理见下图。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。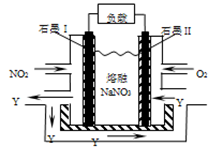
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(本题共13分)甲、乙两同学研究Na2SO3溶液与FeCl3溶液反应的情况。
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com