
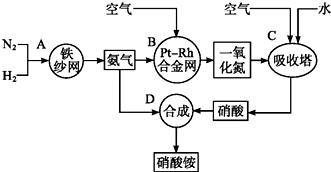
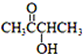 )有如下转化关系,且 1mol B反应生成了2mol C.
)有如下转化关系,且 1mol B反应生成了2mol C.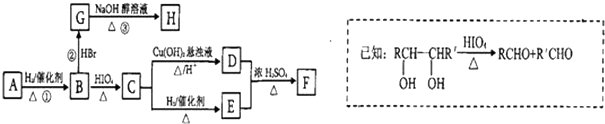
 .
.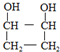 .
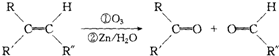
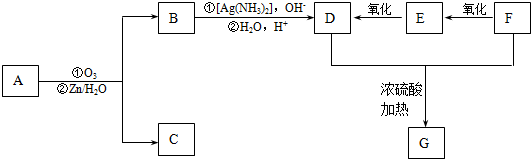
. 分析 由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,据此分析解答.
解答 解:由于A分子中C、H、O三种元素的质量比为6:1:4可知C、H、O的物质的量之比为2:4:1;又由于A的质谱图中质荷比最大值为88,所以A的分子式为C4H8O2,根据分子式可知A中有一个不饱和度,又不能使Br2的CCl4溶液褪色,所以A中存在C=O键,再根据1mol B反应生成了2mol C,结合已知条件可推知A的结构为:CH3COCH(OH)CH3,这样可以进一步推出B、C、D、E、F的结构简式,它们依次是:CH3CH(OH)CH(OH)CH3、CH3CHO、CH3COOH、CH3CH2OH、CH3COOCH2CH3,由于B与HBr发生取代反应生成卤代物,再在NaOH醇溶液中发生消去反应,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构分别为:CH3CHBrCHBrCH3、H3CC≡CCH3,
(1)比较C和E的结构可知,E中氢原子个数比C中多2个,其它原子没有变化再根据反应条件可知该反应为加成反应,故答案为:加成反应;
(2)由A合成H的总产率应为①,②、③三步反应的产率之积,所以由A合成H的总产率=93.0%×81.0%×88.09%=66.3%,故答案为:66.3%;
(3)F为CH3COOCH2CH3,其名称为乙酸乙酯,故答案为:乙酸乙酯;
(4)由上面的分析可知,C为乙醛,它与银氨溶液反应的离子方程式为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2[Ag(NH3)2]++2OH- $\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O;
(5)由于B是2,3-丁二醇,与HBr发生取代反应生成卤代物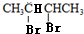 ,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为
,再在NaOH醇溶液中发生消去反应生成H,且H分子中所有碳原子均在一条直线上,所以可以推得G和H的结构,G为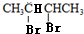 H为
H为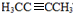 ,G转化为H的化学方程式为
,G转化为H的化学方程式为 ,故答案为:
,故答案为:
(6)A的结构为: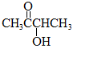 ,其中有8个氢原子,而X中核磁共振氢谱只有3个峰,峰面积之比为1:1:2,所以X是一个非常对称的结构,X中两个氧原子,且1mol X可在HIO4加热的条件下反应,产物只有1mol Y,结合题目信息,说明X中有两个羟基,合X的不饱和度是1,有四个碳原子,所以X中有由四个碳原子构成的环,由此X的结构可以写成
,其中有8个氢原子,而X中核磁共振氢谱只有3个峰,峰面积之比为1:1:2,所以X是一个非常对称的结构,X中两个氧原子,且1mol X可在HIO4加热的条件下反应,产物只有1mol Y,结合题目信息,说明X中有两个羟基,合X的不饱和度是1,有四个碳原子,所以X中有由四个碳原子构成的环,由此X的结构可以写成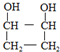 ,故答案为:
,故答案为: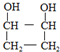 .
.
点评 本题考查了有机官能团的性质、有机结构的推断、有机反应类型、同分异构体的书写等知识,中等难度,解题的难点在第(6)小问,写有条件的同分异构体,对学生掌握有机结构特点及从题中获取信息并灵活运用能力要求较高.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.
+2H2O,反应类型是酯化反应.D与碳酸氢钠反应的化学方程式是HOOCCOOH+2NaHCO3=NaOOCCOONa+2CO2↑+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热△H=-114.6kJ/mol | |
| B. | 由4P(s,红磷)=P4(s,白磷):△H>0可知,白磷的热稳定性比红磷大 | |
| C. | 己知:S(g)+O2(g)=SO2(g);△H1及S(s)+O2(g)=SO2(g):△H2,则△H1<△H2 | |
| D. | 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷燃烧热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ④ | ⑥ | ||||||
| 3 | ① | ② | ③ | ⑤ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所有自发进行的化学反应都是放热反应 | |
| B. | 熵值增大的反应都能自发进行 | |
| C. | 由能量判据和熵判据组合而成的复合判据,适合于所有的反应 | |
| D. | 同一物质的固、液、气三种状态的熵值相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
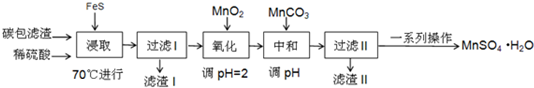
| 物质 | FeS | MnS | HgS |
| 溶度积 | 5×10-18 | 4.6×10-14 | 2×10-54 |
| Fe(OH)2 | Fe(OH)3 | Mn (OH)2 | |
| 开始沉淀时的PH | 6.3 | 2.7 | 8.3 |
| 沉淀完全时的PH | 8.4 | 3.7 | 9.8 |
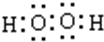 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
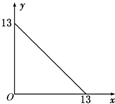 某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:
某温度(t℃)下的溶液中,[H+]=10-xmol•L-1,[OH-]=10-y mol•L-1,x与y的关系如图所示,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可溶性铜盐有毒,故人体内不存在铜元素 | |
| B. | 硅胶可用作食品干燥剂 | |
| C. | 宇航服主要成分是由碳化硅陶瓷和碳纤维复合而成,是一种新型无机非金属材料 | |
| D. | 中秋佳节月饼中用小袋包装的铁粉来防止月饼氧化变质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com