

分析 乙醇在浓硫酸作催化剂、170℃条件下发生消去反应生成B,B为CH2=CH2,丙烯酸和甲醇发生酯化反应生成G,G为CH2=CHCOOCH3,丙酸和甲醇发生酯化反应生成H,H为CH3CH2COOCH3,G和氢气发生加成反应生成H,G发生加聚反应生成高分子化合物,该高分子化合物结构简式为 ,碳化钙和水反应生成乙炔,所以A为HC≡CH,据此分析解答.
,碳化钙和水反应生成乙炔,所以A为HC≡CH,据此分析解答.
解答 解:乙醇在浓硫酸作催化剂、170℃条件下发生消去反应生成B,B为CH2=CH2,丙烯酸和甲醇发生酯化反应生成G,G为CH2=CHCOOCH3,丙酸和甲醇发生酯化反应生成H,H为CH3CH2COOCH3,G和氢气发生加成反应生成H,G发生加聚反应生成高分子化合物,该高分子化合物结构简式为 ,碳化钙和水反应生成乙炔,所以A为HC≡CH,
,碳化钙和水反应生成乙炔,所以A为HC≡CH,
(1)通过以上分析知,G结构简式为CH2═CHCOOCH3,故答案为:CH2═CHCOOCH3;
(2)CO和氢气在催化剂条件下反应生成甲醇,反应方程式为CO+2H2$\stackrel{催化剂}{→}$CH3OH,在浓硫酸作用下,丙酸和甲醇发生酯化反应生成丙酸甲酯,反应方程式为CH3OH+CH3CH2COOH$?_{△}^{浓硫酸}$CH3OOCCH2CH3,
故答案为:CO+2H2$\stackrel{催化剂}{→}$CH3OH;CH3OH+CH3CH2COOH$?_{△}^{浓硫酸}$CH3OOCCH2CH3;
(3)该工艺优点为原料成本低,反应在低温、低压和催化剂条件下进行,能量消耗低,反应过程中没有任何副产品产生,原料利率高,故答案为:原料成本低,反应在低温、低压和催化剂条件下进行,能量消耗低,反应过程中没有任何副产品产生,原料利率高.
点评 本题考查有机物推断,为高频考点,明确官能团及其性质关系是解本题关键,涉及有机物推断、反应方程式的书写,注意反应条件,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ①③ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素丙的单质可用于冶炼金属 | B. | 丙与丁形成的化合物能升华 | ||
| C. | 甲与乙形成的化合物溶于水呈酸性 | D. | 简单离子半径:丁>乙>丙 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
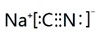 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,加稀硫酸酸化,然后再滴入几滴品红溶液; | 现象:品红不褪色 结论:假设1不成立; |
| 步骤2:另取少量吸收液于试管中, 滴入几滴KSCN溶液. | 现象:溶液变红 结论:假设2成立. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com