
对工业废水和生活污水进行处理是防止水体污染、改善水质的主要措施。
(1)含氰废水中的CN-有剧毒。
①CN-中C元素显+2价, N元素显-3价,用原子结构解释N元素显负价的原因是 ,共用电子对偏向N原子,N元素显负价。
②在微生物的作用下,CN-能够被氧气氧化成HCO3-,同时生成NH3,该反应的离子方程式为 。
(2)含乙酸钠和对氯酚(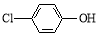 )的废水可以利用微生物电池除去,其原理如下图所示。
)的废水可以利用微生物电池除去,其原理如下图所示。
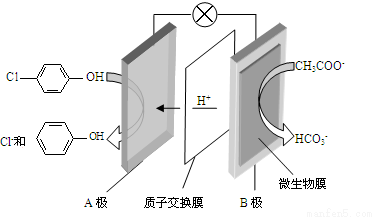
①B是电池的 极(填“正”或“负”);
②A极的电极反应式为 。
(3)电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如下图所示(图中“HA”表示乳酸分子,A- 表示乳酸根离子)。
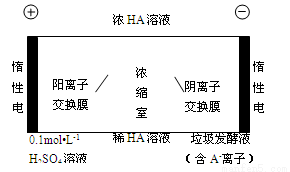
阳极的电极反应式为 。
简述浓缩室中得到浓乳酸的原理: 。
③ 电解过程中,采取一定的措施可控制阳极室的pH约为6-8,此时进入浓缩室的OH-可忽略不计。400mL 10 g?L-1乳酸溶液通电一段时间后,浓度上升为145 g?L-1(溶液体积变化忽略不计),阴极上产生的H2在标准状况下的体积约为 L。(乳酸的摩尔质量为90 g? mol-1)
(1)①C和N的原子电子层数相同,核电荷数C小于N,最外层电子数C小于N,原子半径C大于N,得电子能力C弱于N
② 2CN-+ 4H2O + O2  2HCO3- + 2NH3
2HCO3- + 2NH3
(2)①负;② Cl- -OH + e- + H+ ===
-OH + e- + H+ ===  -OH + Cl-
-OH + Cl-
(3)①4OH--4e-=== 2H2O+O2↑
② 阳极OH-放电,c(H+)增大,H+从阳极通过阳离子交换膜进入浓缩室;
A-通过阴离子交换膜从阴极进入浓缩室,H+ +A- === HA,乳酸浓度增大。
③ 6.72
【解析】
试题分析:(1)①C和N是第二周期元素的原子,它们的原子电子层数相同(同周期),但是核电荷数C小于N,所以原子半径C大于N,即吸引电子能力C弱于N,所以C、N形成的化合物共用电子对偏向N原子,N元素显负价。
②CN-能够被氧气氧化成HCO3-,同时生成NH3得出方程式为:2CN-+4H2O+O2 2HCO3-+2NH3。
2HCO3-+2NH3。
(2)①原电池中氢离子的移动方向是从负极流向正极,所以B是电池的负极。
②A是正极,正极上发生得电子的还原反应:Cl- -OH + e- + H+ ===
-OH + e- + H+ ===  -OH + Cl-。
-OH + Cl-。
(3)①阳极上是阴离子氢氧根离子发生失电子的氧化反应,电极反应式为:4OH--4e-═2H2O+O2↑。
②在电解池的阳极上是OH-放电,所以c(H+)增大,并且H+从阳极通过阳离子交换膜进入浓缩室;根据电解原理,电解池中的阴离子移向阳极,即A-通过阴离子交换膜从阴极进入浓缩室,这样:H++A-═HA,乳酸浓度增大。
③在阳极上发生电极反应:4OH--4e-═2H2O+O2↑,阴极上发生电极反应:2H++2e-=H2↑,根据电极反应方程式,则有:HA~H+~1/2H2,根据差值法,乳酸的浓度变化量是(145g?L-1-10g?L-1)÷90g/mol=1.5mol/L,即生成HA的物质的量是1.5mol/L×0.4L=0.6mol,所以产生氢气是0.3mol即0.3mol×22.4L/mol=6.72L。
考点:本题考查原子结构、电解池和原电池原理及应用。


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源:2015届吉林省吉林市高三第一次摸底考试化学试卷(解析版) 题型:选择题
现加热5.00gNa2CO3和NaHCO3的混合物,使NaHCO3完全分解,混合物质量减少了0.31g,则原混合物中Na2CO3的质量分数是
A.91.6% B. 8.4% C.83.2% D.88.2%
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:填空题
(4分)某温度下,在2 L密闭容器中,x、y、z三种物质的物质的量随时间变化曲线如图所示,
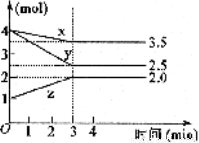
由图分析:
(1)该反应的化学方程式是_________________。
(2)3 min末,用y的浓度变化表示的反应速率V(y)为___________。
(3)反应是由_____________开始的反应。
A.正反应 B.逆反应 C.正、逆反应同时
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
氨水中有下列平衡NH3·H2O NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
NH4++OH—当其它条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
A、加NaOH B、加HCl C、加NH4Cl D、加同浓度的氨水
查看答案和解析>>
科目:高中化学 来源:2015届北京理工附中高三第一次月考化学试卷(解析版) 题型:选择题
反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
CO(g)+H2(g)在一可变容积的密闭容器中进行,在其它条件不变的情况下,下列条件的改变对其反应速率几乎无影响的是
A、增加CO的物质的量
B、将容器的体积缩小一半
C、保持体积不变,充入N2使体系压强增大
D、保持压强不变,充入N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KClO3,且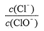 的值与温度高低有关。当n(KOH) = a mol时,下列有关说法错误的是
的值与温度高低有关。当n(KOH) = a mol时,下列有关说法错误的是
A.参加反应的氯气的物质的量等于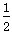 a mol
a mol
B.若某温度下,反应后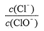 =11,则溶液中
=11,则溶液中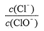 =
=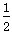
C. 改变温度,产物中KC1O3的最大理论产量为 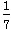 a mol
a mol
D.改变温度,反应中转移电子的物质的量ne的范围: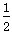 a mol ≤ ne ≤
a mol ≤ ne ≤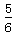 a mol
a mol
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
将足量CO2通入KOH和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入CO2体积(y)的关系正确的是
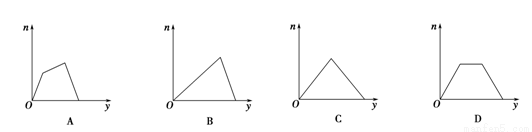
查看答案和解析>>
科目:高中化学 来源:2015届北京市高三上学期第一次质量检测化学试卷(解析版) 题型:填空题
常温下,往H2O2溶液中滴加少量FeSO4溶液,可发生如下两个反应:
2Fe2++H2O2+2H+=2Fe3++2H2O 2Fe3++H2O2=2Fe2++O2↑+2H+ ,由此说明:
,由此说明:
(1)H2O2的氧化性比Fe3+ ,其还原性比Fe2+ (填“强”或“弱”)
 (2)
(2) 在H2O2分解过程中,FeSO4溶液 的作用是
在H2O2分解过程中,FeSO4溶液 的作用是
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法不正确的是
A.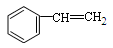 没有顺反异构体
没有顺反异构体
B.1,3-丁二烯可以作为合成高分子化合物的原料
C.用乙醇和浓硫酸制备乙烯时,用水浴加热控制反应温度
D.常温下,将苯酚加入到少量水中有浑浊,滴入适量NaOH溶液后浑浊消失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com