
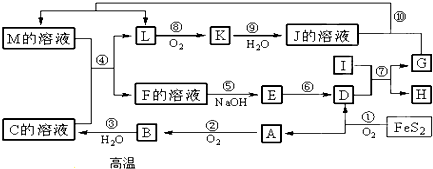
分析 I是由地壳中含量最多的金属元素组成的单质,则I应为Al,K是一种红棕色气体,判断为NO2,则J为HNO3,L为NO;反应①为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,且A能与氧气反应生成B,则A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I与D反应生成G为金属单质,则可知该反应为铝热反应,所以G为Fe,H为Al2O3,过量的G可与J溶液反应得到M,M应为Fe(NO3)2;M和C反应得F为Fe(NO3)3或Fe2(SO4)3;F与氢氧化钠反应得E应为Fe(OH)3,E受热分解得D,据此答题.
解答 解:I是由地壳中含量最多的金属元素组成的单质,则I应为Al,K是一种红棕色气体,判断为NO2,则J为HNO3,L为NO;反应①为4FeS2+11O2 $\frac{\underline{\;高温\;}}{\;}$2Fe2O3+8SO2,且A能与氧气反应生成B,则A为SO2,D为Fe2O3,B为SO3,C为H2SO4;I与D反应生成G为金属单质,则可知该反应为铝热反应,所以G为Fe,H为Al2O3,过量的G可与J溶液反应得到M,M应为Fe(NO3)2;M和C反应得F为Fe(NO3)3或Fe2(SO4)3;F与氢氧化钠反应得E应为Fe(OH)3,E受热分解得D.
(1)G为Fe,在周期表中的位置是第四周期第Ⅷ族,故答案为:四、Ⅷ;
(2)反应⑦为铝热反应,反应方程式为:Fe2O3+2Al$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,Fe2O3是氧化剂,Al是还原剂,二者物质的量之比为1:2,故答案为:1:2;
(3)反应②为:2SO2+O2$\frac{\underline{催化剂}}{△}$2SO3,属于氧化还原反应;反应③为SO3+H2O=H2SO4,属于非氧化还原反应;反应④是3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,属于氧化还原反应;反应⑤是Fe3++3OH=Fe(OH)3↓,属于非氧化还原反应;反应⑥为2Fe(OH)3$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2O,属于非氧化还原反应,
故答案为:②④;
(4)反应④的离子方程式为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,
故答案为:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O;
(4)将化合物D与KNO3、KOH共融,可制得一种“绿色”环保高效净水剂K2FeO4(高铁酸钾),同时还生成KNO2和H2O,根据元素守恒和氧化还原反应中电子得失守恒可知,该反应的化学方程式为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O,
故答案为:Fe2O3+3KNO3+4KOH$\frac{\underline{\;高温\;}}{\;}$2K2FeO4+3KNO2+2H2O.
点评 本题考查无机物的推断,“FeS2与氧气反应、K与E的颜色、I的性质”等时推断的突破口,结合转化进行推断,需要学生熟练掌握元素化合物性质,题目难度中等.


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水小 | |
| B. | H2A溶液在不同pH环境中各微粒的分布不同,电离平衡常数也不同 | |
| C. | 溶液的pH=4.5时,存在如下关系:C(Na+)>C(HA-)>C(A2-)>C(H+)>C(OH-) | |
| D. | 已知HClO的电离平衡常数为10-7.5将少量H2A 的溶液加入足量NaClO溶液中,发生的反应为:H2A+ClO-═HClO+HA- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 滴加甲基橙试剂呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH为11的溶液:S2-、SO32-、S2O32-、Na+ | |
| C. | 水电离出来的c (OH-)=10-13mol/L的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 无色透明的溶液:K+、SiO32-、NO3-、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com