
【题目】1-溴丙烷是一种重要的有机合成中间体。实验室用丙醇、浓硫酸和溴化钠反应来制备少量1-溴丙烷。其反应原理、实验的装置和主要步骤如下:H2SO4(浓)+NaBr ![]() NaHSO4+HBr↑ CH3CH2CH2OH+HBr
NaHSO4+HBr↑ CH3CH2CH2OH+HBr ![]() CH3CH2CH2Br+H2O
CH3CH2CH2Br+H2O
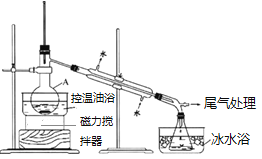
步骤1:在仪器A中加入搅拌磁子、12g正丙醇及20mL水,冰水冷却下缓慢加入28mL浓![]() ;冷却至室温,搅拌下加入24g NaBr。
;冷却至室温,搅拌下加入24g NaBr。
步骤2:如图所示连接实验装置,缓慢加热,直到没有油状物馏出为止。
步骤3:将馏出液转入分液漏斗,分出有机相。
步骤4:将分出的有机相转入分液漏斗,依次用![]() 溶液
溶液 ![]() 洗涤,分液,得粗产品,进一步提纯得
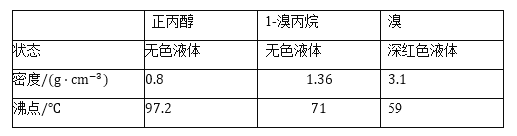
洗涤,分液,得粗产品,进一步提纯得![]() 溴丙烷。有关数据见下表:
溴丙烷。有关数据见下表:
(1)仪器A的名称的是_________;加入搅拌磁子的目的是搅拌和___________。
(2)反应时生成的主要有机副产物有丙烯、_________和___________。(填物质名称)
(3)反应过程中可以观察到A的上方出现红棕色气体,其分子式为__________。
(4)给A加热的目的是_______。
(5)步骡2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是_______,同时可以观察到的现象是_____。
(6) 步骤4中三次洗涤分别洗去的主要杂质①__________②___________③___________ .
(7)步骤4中![]() 的
的![]() 溶液还可以用下列哪个试剂代替_____(填字母序号)
溶液还可以用下列哪个试剂代替_____(填字母序号)
A.NaOH溶液 ![]() 溶液 C.
溶液 C.![]() 溶液 D.
溶液 D.![]()
【答案】蒸馏烧瓶 防止暴沸 正丙醚 1,![]() 二溴丙烷 Br2 升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率 冷凝收集
二溴丙烷 Br2 升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率 冷凝收集![]() 溴丙烷;并起到液封
溴丙烷;并起到液封![]() 溴丙烷减少其挥发 溶液分层,下层为略带橙色的油状液体 正丙醇
溴丙烷减少其挥发 溶液分层,下层为略带橙色的油状液体 正丙醇 ![]()
![]()
![]() 。
。
【解析】
(1)由图可知,仪器A的名称是蒸馏烧瓶,加入搅拌磁子的目的是搅拌和防止暴沸,故答案为:蒸馏烧瓶;防止暴沸。
(2)正丙醇在浓硫酸作用下可能发生消去反应,或分子间取代反应,则反应时生成的主要有机副产物有1,2-二溴丙烷和丙烯、正丙醚,故答案为:1,2-二溴丙烷、正丙醚。
(3)根据题中所给信息可知A上方出现红棕色气体应为溴蒸气,化学式为Br2,故答案为:Br2。
(4)给A加热的目的是升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率,故答案为:升高温度加快反应速率;同时使生成的1-溴丙烷分离出来促进反应正向进行,提高产率。
(5)步骤2中需向接受瓶内加入少量冰水并置于冰水浴中的目的是冷凝收集![]() 溴丙烷;并起到液封
溴丙烷;并起到液封![]() 溴丙烷减少其挥发,同时可以观察到溶液分层,下层为略带橙色的油状液体,故答案为:冷凝收集
溴丙烷减少其挥发,同时可以观察到溶液分层,下层为略带橙色的油状液体,故答案为:冷凝收集![]() 溴丙烷,并起到液封
溴丙烷,并起到液封![]() 溴丙烷减少其挥发;溶液分层,下层为略带橙色的油状液体。
溴丙烷减少其挥发;溶液分层,下层为略带橙色的油状液体。
(6)步骤4:将分出的有机相转入分液漏斗,①用12mLH2O洗涤,主要是除去正丙醇,②用12mL5%Na2CO3溶液洗涤,主要是除去单质Br2,③再用12mLH2O洗涤,主要是除去Na2CO3,故答案为:正丙醇,Br2,Na2CO3。
(7)A.NaOH溶液:加NaOH会引起溴乙烷的水解,故A不选;
B.NaI溶液:除去溴乙烷中的少量杂质溴,加入NaI会引入碘单质杂质,故B不选;
C.Na2SO3溶液:加Na2SO3溶液只与溴反应不与溴乙烷反应,故C选;
D.CCl4:溴乙烷会溶解在CCl4中,故D不选。
故答案为:C。


 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】通过以下反应可获得新型能源二甲醚(![]() )。下列说法不正确的是
)。下列说法不正确的是
①![]()
![]()
②![]()
![]()
③![]()
![]()
④![]()
![]()
A. 反应①、②为反应③提供原料气
B. 反应③也是![]() 资源化利用的方法之一
资源化利用的方法之一
C. 反应![]() 的
的![]()
D. 反应![]() 的
的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室处理含FeBr3废催化剂的溶液,可得到溴的苯溶液和无水FeCl3。下列做法能达到相应实验目的的是
A | B | C | D |
|
|
|
|
制取Cl2 | 使Br-转化为Br2 | 分离出溴的苯溶液 | 将分液后的水层蒸干获得无水FeCl3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在甲、乙、丙三个恒温恒容的密闭容器中,分别加入足量活性炭和一定量的 NO,进行反应C(s)+2NO(g) ![]() N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
N2(g)+CO2(g), 测得各容器中 c(NO)随反应时间 t 的变化情况如下表所示,下列说法正确的是( )
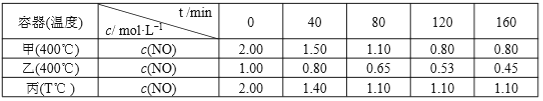
A.达到平衡状态时,2v 正(NO)= v 逆(N2)
B.活性炭的质量不再改变不能说明反应已达平衡状态
C.丙容器中,从反应开始到建立平衡时的平均反应速率为 v (NO) >0.01125mol·L-1·min-1
D.由表格数据可知:T<400℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废旧电路板为原料制备硫酸铜可以变废为宝。下图是某科研小组设计的工艺流程(流程中 RH 为萃取剂),下列说法不正确的是

A.“粉碎”可以增大反应的接触面积,提高浸取速率和铜的浸取率
B.“浸取”发生的离子反应为 Cu+H2O2+2NH3 +2NH4+=Cu(NH3)42++2H2O
C.工艺流程中循环使用的物质有 NH3、NH4Cl、RH 和有机溶剂
D.从硫酸铜溶液获得纯净的硫酸铜晶体的操作是:加入适量乙醇,蒸发浓缩、冷却结晶、过滤、热水洗涤、干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑩在表中的位置,用化学用语回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)在这些元素中,化学性质最不活泼的元素的原子结构示意图为___,形成的单质是半导体的是___(填元素名称)。
(2)⑥与⑨形成的化合物的电子式为___,①与②形成的最简单化合物的结构式为___。
(3
(4)气态氢化物最稳定的是___(填化学式),②、③、⑧的原子半径最小是__(填素符号)。
(5)④与⑧形成的化合物的属于___(填“离子化合物”或“共价化合物”),该晶体属于___晶体(填“离子”、“分子”、“原子”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程中所发生的化学变化属于取代反应的是( )
A.苯与浓溴水混合后撒入铁粉
B.乙醇、乙酸与浓硫酸混合后加热
C.在加热及镍作催化剂的条件下,苯与氢气反应
D.在加热及铜作催化剂的条件下,乙醇与氧气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y的负一价离子的最外层电子数与次外层的相同。回答下列问题:
(1)单质M的晶体类型为________,晶体中原子间通过________作用形成面心立方密堆积,其中M原子的配位数为________。
(2)元素Y基态原子的核外电子排布式为________,其同周期元素中,第一电离能最大的是________(写元素符号)。元素Y的含氧酸中,酸性最强的是________(写化学式)
(3)M与Y形成的一种化合物的立方晶胞如图所示。该化合物的化学式为________,已知晶胞参数a=0.542 nm,此晶体的密度为__________g·cm-3。(列式,不要求结果,阿伏加德罗常数为NA)
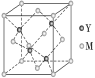
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,
其中反应条件及部分产物均已略去,则下列有关说法正确的是
A.X使蔗糖变黑的现象主要体现了X的强氧化性
B.若A为铁,则足量A与X在室温下即可完全反应
C.若A为碳单质,则将C通入少量的澄清石灰水中,最后有白色沉淀产生
D.工业上,B转化为D的反应条件为加热、使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com