
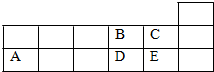
| A. | 它们的简单离子半径大小关系为:A>D>E>B>C | |
| B. | 氧化物的水化物的酸性强弱关系:E>D>A | |
| C. | 化合物E2B的分子中B原子的杂化方式为sp3 | |
| D. | 工业上将E单质通入澄清石灰水中反应制漂白粉 |
分析 由元素在周期表中的位置可知A为Al元素,B为O元素,C为F元素,D为S元素,E为Cl元素.
A.电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小;
B.比较如不是最高价氧化物的水化物,则不能确定酸性强弱;
C.化合物Cl2O中O形成2gδ个键,且含有2个孤电子对;
D.工业用氯气和石灰乳反应制备漂白粉.
解答 解:A为Al元素,B为O元素,C为F元素,D为S元素,E为Cl元素.
A.电子层越多,离子半径越大,电子层相同时,核电荷数越大,离子半径越小,简单离子半径大小关系为D>E>B>C>A,故A错误;
B.比较如不是最高价氧化物的水化物,则不能确定酸性强弱,故B错误;
C.化合物Cl2O中O形成2gδ个键,且含有2个孤电子对,则杂化方式为sp3,故C正确;
D.工业用氯气和石灰乳反应制备漂白粉,澄清石灰水的浓度较低,故D错误.
故选C.
点评 本题考查了原子结构与元素周期律的关系,为高频考点,题目难度中等,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 先生成CuS后生成ZnS沉淀,属于沉淀的转化 | |
| B. | 当ZnS沉淀完全时,溶液中$\frac{{c(C{u^{2+}})}}{{c(Z{n^{2+}})}}$=6.5×10-15 | |
| C. | 过滤得到的沉淀是CuS和ZnS的混合物 | |
| D. | 过滤后得到的溶液中仍有极少量的Cu2+和Zn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯属于不饱和链烃,乙烷属于饱和链烃 | |
| B. | 乙烯分子中所有原子处于同一平面上,乙烷分子中的原子不在同一平面上 | |
| C. | 乙烯分子中的 双键比乙烷分子中的 C-C 单键更稳定,性质更活泼 | |
| D. | 乙烯能使酸性 KMnO4 溶液褪色,乙烷不能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 组成元素都属于主族元素 | B. | 组成元素都属于非金属元素 | ||
| C. | 分子中只含有共价键 | D. | 分子中既含有共价键又含有离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13.8g | B. | 8.5g | C. | 9.8g | D. | 8.89 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CBr2F2 | B. | CH3CH(OH)COOH | C. | CH3CH2CH3 | D. | CH3CH2OH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com