
| 操作及现象 | 结论 | |
| A | 向PbSO4悬浊液中加入KI溶液时出现黄色沉淀 | Ksp(PbI2)<Ksp(PbSO4) |
| B | 向某溶液中滴加氯水后再加入稀C6H5OH溶液,溶液呈红色 | 原溶液中可能含有Fe2+ |
| C | 向Na2SiO3溶液中通入过量SO2气体 | 反应为:SiO${\;}_{3}^{2-}$+SO2+H2O=H2SiO3↓+SO${\;}_{3}^{2-}$ |
| D | 将氢气还原氧化铜所得的红色固体加入足量稀硝酸中,溶液变为蓝色 | 反应为:3Cu+2NO${\;}_{3}^{-}$+8H+=3Cu2++2NO↑+4H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.向PbSO4悬浊液中加入KI溶液时出现黄色沉淀,发生沉淀的转化,生成Ksp小的物质;
B.原溶液在可能含铁离子;
C.向Na2SiO3溶液中通入过量SO2气体,反应生成硅酸和亚硫酸氢钠;
D.红色固体为Cu,Cu与稀硝酸反应生成硝酸铜.
解答 解:A.向PbSO4悬浊液中加入KI溶液时出现黄色沉淀,发生沉淀的转化,生成Ksp小的物质,则Ksp(PbI2)<Ksp(PbSO4),故A正确;
B.原溶液在可能含铁离子,应先加苯酚,后加氯水检验亚铁离子,故B错误;
C.向Na2SiO3溶液中通入过量SO2气体,反应生成硅酸和亚硫酸氢钠,则离子反应为SiO32-+2SO2+2H2O=H2SiO3↓+2HSO3-,故C错误;
D.红色固体为Cu,Cu与稀硝酸反应生成硝酸铜,溶液变为蓝色,故D正确;
故选AD.
点评 本题考查化学实验方案的评价,为高频考点,把握沉淀转化、离子检验、物质的性质及反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
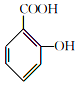 +
+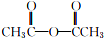 $→_{75-80℃}^{H_{3}PO_{4}}$
$→_{75-80℃}^{H_{3}PO_{4}}$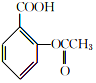 +CH3COOH
+CH3COOH| 名称 | 式量 | 性质 | 熔点/℃ | 沸点/℃ | 溶解度 | ||
| 水 | 乙醇 | 乙酸乙酯 | |||||
| 水杨酸 | 138 | 白色结晶粉末、无臭 | 157~159 | 211 | 溶 | 易溶 | 易溶 |
| 醋酸酐 | 102 | 无色液体、易燃、有醋酸味 | -73.1 | 138.6 | 易溶 | 溶 | 易溶 |
| 乙酸水杨酸 | 180 | 白色针状结晶 | 135 | 321.4 | 冰水微溶、热水可溶 | 易溶 | 微溶 |
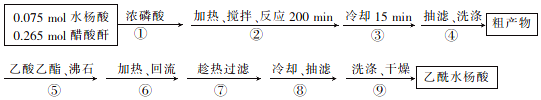
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl:我是离子化合物,含有极性键 | |
| B. | H2O:我1mol中含有2mol非极性键 | |
| C. | KOH:既含有离子键,又含有极性共价键 | |
| D. | NaNO3:我是含有离子键的共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原料来源广 | B. | 易燃烧,放出热量多 | ||
| C. | 产物无污染 | D. | 制取H2简单易行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
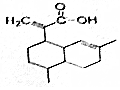 有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )
有机物X可作为合成青蒿素的一种基本原料,已知X的结构如图,下列有关X的说法正确的是( )| A. | X为烃的含氧衍生物 | |
| B. | 1molX最多可以和3mol H2发生加成反应 | |
| C. | X只能发生取代反应和加成反应 | |
| D. | X可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且褪色原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.6g | B. | 11.2g | C. | 16.8g | D. | 22.4g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷、乙烯 | B. | 乙烷、乙烯 | C. | 乙烷、丙烯 | D. | 甲烷、丙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com