
氢氧燃料电池的原理如图所示:
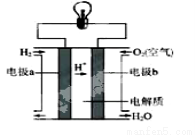
回答下列问题:
(1)反应时电子从 极流出(填a 或b )
(2)若电解质溶液为H2SO4溶液,则正极的电极反应式为 ,电池工作一段时间后,电解质溶液的酸性将会 (填“增强”、“减弱”或“不变”)
(3)若电解质溶液为KOH溶液,则负极的电极反应式为 ,
(4)电池工作时若转移4mol电子,则理论上需通入标况下的氢气 L.
 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源:2015-2016学年广东省肇庆市高二下期末化学试卷(解析版) 题型:填空题
(1)含碳物质不完全燃烧会产生剧毒的CO,根据价键理论,CO的电子式为 ,结构式为 。
(2)长期以来一直认为氟的含氧酸不存在。自1971年美国科学家用F2通过细冰末获得HFO(俗称“次氟酸”)以来,对HFO的研究引起重视。
①HFO的电子式为 ,则HFO的结构式为 (在HFO的结构式中标出各元素的化合价)。
②对比其它次卤酸可以看出,把HFO称着“次氟酸”其实不妥当的,理由是 。
③次氟酸能与水反应生成两种物质,其中有一种物质为HF(常用于雕刻玻璃),则次氟酸与水反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆伊犁州伊宁二中高二下期末化学试卷(解析版) 题型:选择题
X、Y、Z三种元素的原子,其最外层电子排布分别为ns1、3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是( )
A. XYZ2 B. X2YZ4 C. X2YZ2 D. XYZ3
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高二下期末化学试卷(解析版) 题型:选择题
质谱显示,某有机化合物的相对分子质量为46,燃烧实验发现其分子中碳、氢原子数之比为1∶3,核磁共振谱显示,该物质中只有一种类型的氢原子。关于该化合物的描述中,正确的是( )
A.该化合物为乙醇
B.该化合物与乙醇互为同分异构体
C.该化合物为乙醚
D.该化合物与乙醚互为同分异构体
查看答案和解析>>
科目:高中化学 来源:2015-2016学年新疆石河子二中高二下期末化学试卷(解析版) 题型:选择题
下列与有机物结构、性质相关的叙述错误的是
A.乙酸分子中含有羧基,可与NaHCO3溶液反应生成CO2
B.蛋白质和油脂都属于高分子化合物,一定条件下都能水解
C.甲烷和氯气反应生成一氯甲烷,与苯和硝酸反应生成硝基苯的反应类型相同
D.苯 不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
不能使溴的四氯化碳溶液褪色,说明苯分子中没有与乙烯分子中类似的碳碳双键
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高一下期末化学试卷(解析版) 题型:选择题
下列文字表述与反应方程式对应且正确的是( )
A.溴苯中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+=AgBr↓
B.利用腐蚀法制作印刷线路板:2Fe3+ + Cu =2Fe + Cu2+
C.用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
D.实验室用液溴和苯在催化剂作用下制溴苯:
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高一下期末化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是( )
A.1mol/L Na2CO3溶液中的Na+ 数目为2NA
B.标准状况下,11.2LSO3所含分子数为0.5NA
C.1 mol Na与足量O2反应生成Na2O或Na2O2均失去NA电子
D.各5.6 g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省华蓥市高二下期末化学试卷(解析版) 题型:选择题
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
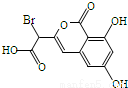
A.1mol该有机物最多可以和4mol Na反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年内蒙古高一下期末化学试卷(解析版) 题型:填空题
已知N2O4和NO2可以相互转化:2NO2(g)  N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
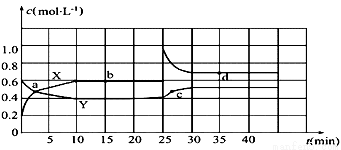
(1)图中曲线______(填“X”或“Y”)表示c(N2O4)随时间的变化。
(2)从起点开始首次达到平衡时,以NO2表示的反应速率为______。
(3)图中b点的平衡常数K的值为________。
(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,则v正_____v逆(填“>”、“=”或“<”);若升温该反应的平衡常数K______(填“增大”、“减小”或“不变”) ,判断理由是_________________。
(5)25min时,改变的外界条件是______,图象中a、b、c、d四点中v正=v逆的点是____,四点中________点体系颜色最深。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com