
| A. | 钠融法 | B. | 铜丝燃烧法 | C. | 核磁共振法 | D. | 红外光谱法 |
科目:高中化学 来源: 题型:选择题
| A. | ZYXW | B. | WXYZ | C. | XYZW | D. | ZXYW |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
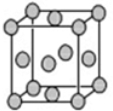
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
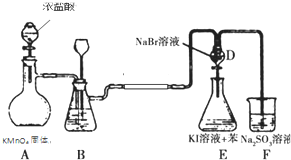
| A. | F2不能与NaCl溶液反应置换出氯气 | |
| B. | 装置B中可盛放水吸收氯气中的HCl气体 | |
| C. | 装置E下层呈现紫红色 | |
| D. | 装置E中有机试剂层呈现紫红色,能说明非金属性Br>I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2,HCl,HC≡CCH3 | B. | C6H6,C2H4,CO2 | C. | C6H6,HCl,CH4 | D. | C2H6,HCl,C2H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省长春市高一上学期期初考试化学试卷 题型:选择题
NaHS、MgSO4、NaHSO4三种物质组成的混合物中,已知氧元素的质量分数为a%,则其中硫元素的质量分数为
A.a%
B.1-1.75%
C.4(1-a%)/7
D.3(1-a%)/7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com