
| A. | △H4=△H1+△H3-△H2 | B. | △H4=△H1+2△H3-△H2 | ||
| C. | △H4=△H2+△H1+2△H3 | D. | △H4=2(△H2-△H1+2△H3) |
分析 根据CO的燃烧热△H3,则③2CO(g)+O2(g)═2CO2(g)2△H3,又①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1.②2NO(g)+O2(g)═2NO2(g)△H2;利用盖斯定律,2NO2(g)+4CO(g)═N2(g)+4CO2(g)由①+2×③-②,计算得到.
解答 解:因为CO的燃烧热△H3,则③2CO(g)+O2(g)═2CO2(g)2△H3,又①2CO(g)+2NO(g)?N2(g)+2CO2(g)△H1.②2NO(g)+O2(g)═2NO2(g)△H2;利用盖斯定律,2NO2(g)+4CO(g)═N2(g)+4CO2(g)由①+2×③-②,所以△H4=△H1+2△H3-△H2,故选:B.
点评 本题主要考查了盖斯定律的应用,难度不大,注意燃烧热是指1mol可燃物的热效应.


科目:高中化学 来源: 题型:选择题
| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇和浓硫酸加热至140℃反应:2CH3CH2OH$\stackrel{140℃}{→}$CH3CH2OCH2CH3+H2O | |
| B. | 溴乙烷与NaOH醇溶液加热反应:CH3CH2Br+NaOH$→_{△}^{醇}$CH2═CH2↑+NaBr | |
| C. | 苯酚钠溶液中通少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH↓+HCO3- | |
| D. | 乙醛溶液与银氨溶液共热:2CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$2CH3COONH4+2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.5 mol•L-1•s-1 | B. | υ(D)=1 mol•L-1•s-1 | ||
| C. | υ(C)=1.2 mol•L-1•s-1 | D. | υ(B)=0.5 mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用石蕊试纸检验气体需要现用蒸馏水湿润 | |
| B. | 使用容量瓶要先检查是否漏水 | |
| C. | 使用锥形瓶进行酸碱中和滴定要先用待测液润洗 | |
| D. | 使用棕色瓶保存浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 存在于O2、SO2和SO3中 | B. | 只存在于O2和SO3中 | ||
| C. | 只存在于O2和SO2中 | D. | 只存在于O2中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
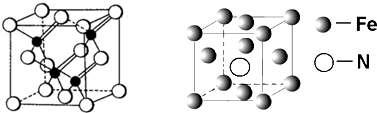
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
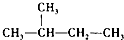 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com