
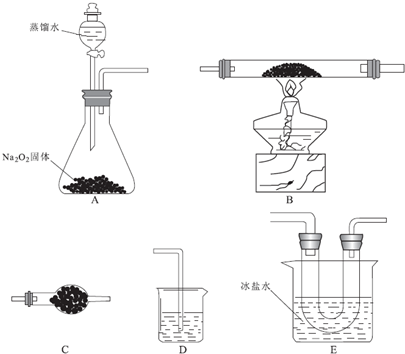
分析 探究氯化亚铁制取氯化铁的性质实验:反应原理为:12FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8FeCl3.首先制取氧气,装置A:2Na2O2+2H2O=4NaOH+O2↑,制取的氧气中含有水蒸气,因三氯化铁易溶于水并且有强烈的吸水性,需除去氧气中的水蒸气,选用装置C,在500℃条件下氯化亚铁与氧气可能发生多种反应,装置B中:12FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8FeCl3,同时发生副反应4FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4Cl2,待B中充分反应后,停止加热后,还需持续通氧气至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,三氯化铁在300℃以上易升华,利用装置E浓盐水冷却氯化铁,E装置U形管左边设计为粗导管的目的是防止FeCl3冷凝在导管中,堵塞导管,在尾气处理前组装个吸水干燥装置的说明,目的是为了防止外界空气进入,引入水蒸气的干扰影响,最后用装置D盛放碱性溶液吸收尾气.
(1)根据实验的目的制取氯化铁,首先制取氧气,其次除去氧气中的水蒸气,然后制取、收集,最后进行尾气处理,据此连接实验装置,因三氯化铁易凝华,其中E装置U形管左边设计为粗导管的目的是防止FeCl3冷凝在导管中,堵塞导管;
(2)过氧化钠和水反应生成氢氧化钠和氧气;
(3)黄绿色气体为氯气,说明氯化亚铁和氧气反应生成红棕色氧化铁和黄绿色氯气,据此书写方程式;
(4)待B中充分反应后,停止加热后,还需持续通氧气,当装置中的黄绿色气体完全消失,反应停止;
(5)①利用氯化铁为强酸弱碱盐水解呈酸性进行检验;
②将装置B的残留固体溶于酸,加氧化剂将铁转化为铁离子,加入碱生成氢氧化铁沉淀,转化为氧化铁,根据氧化铁测定装置B的残留固体中铁元素的质量分数.
解答 解:(1)氯化亚铁制取氯化铁的性质实验:反应原理为:12FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8FeCl3.首先制取氧气,装置A:2Na2O2+2H2O=4NaOH+O2↑,制取的氧气中含有水蒸气,因三氯化铁易溶于水并且有强烈的吸水性,需除去氧气中的水蒸气,选用装置C,在500℃条件下氯化亚铁与氧气可能发生多种反应,装置B中:12FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8FeCl3,同时发生副反应4FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4Cl2,待B中充分反应后,停止加热后,还需持续通氧气至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,三氯化铁在300℃以上易升华,利用装置E浓盐水冷却氯化铁,E装置U形管左边设计为粗导管的目的是防止FeCl3冷凝在导管中,堵塞导管,最后用装置D盛放碱性溶液吸收尾气,
故答案为:CBEC;防止FeCl3冷凝在导管中,堵塞导管;
(2)装置A中过氧化钠和水反应生成氢氧化钠和氧气,反应方程式为:2Na2O2+2H2O=4NaOH+O2↑,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;
(3)装置B中生成红棕色固体为氧化铁,观察到黄绿色气体为氯气,氯化亚铁和氧气反应生成氧化铁和氯气,反应方程式为:4FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4Cl2,
故答案为:4FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+4Cl2;
(4)待B中充分反应后,停止加热后,还需持续通氧气,至硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失,保证装置B中:12FeCl2+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe2O3+8FeCl3,反应完全,
故答案为:硬质玻璃管冷却到室温且装置中的黄绿色气体完全消失;
(5)①验证Fe(OH)3是弱碱,可通过氯化铁为强酸弱碱盐水解呈酸性进行检验,取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证,
故答案为:取少量固体加水溶解,用pH试纸(或pH计)测得溶液显酸性,即证;
②测定装置B的残留固体中铁元素的质量分数,可通过测定氧化铁实验,操作为:称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后,再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量,
故答案为:称取一定质量B中的残留固体,加入足量的盐酸(或硫酸等)溶解,加足量的H2O2氧化后(不答也可)再加入足量氢氧化钠溶液得沉淀,过滤、洗涤、在空气中充分灼烧至恒重称量.
点评 本题考查实验探究氯化亚铁制取氯化铁,为高频考点,把握制备实验原理、铁的性质等为解答的关键,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,乙酸官能团的名称羧基.
,乙酸官能团的名称羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
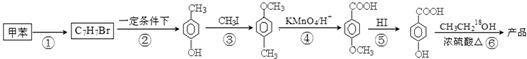
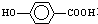 在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式)
在一定条件下发生聚合反应生成高分子化合物,写出该反应的化学方程式(有机物写结构简式) .
.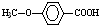 的同分异构体很多,其中符合下列条件有3种.
的同分异构体很多,其中符合下列条件有3种. .
.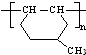 是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:
是一种建筑材料,根据题中合成路线信息,以甲苯为原料合成该高分子化合物,请设计合成路线(无机试剂及溶剂任选)注:合成路线的书写格式参照如下示例流程图:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
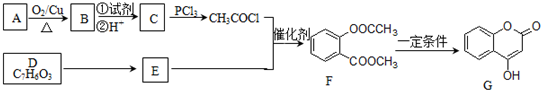


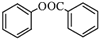 )的合成路线流程图(无机原料任用).
)的合成路线流程图(无机原料任用).查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | Cu2+物质的量浓度 | B. | Cl-物质的量浓度 | ||
| C. | Cu极质量 | D. | C(石墨)极质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
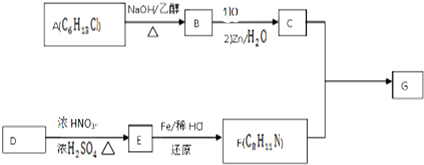
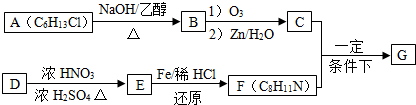
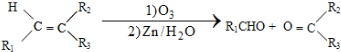
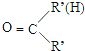 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +HO-NO2$→_{△}^{浓硫酸}$
+HO-NO2$→_{△}^{浓硫酸}$  +H2O.
+H2O. .
. .(写出其中的一种的结构简式).
.(写出其中的一种的结构简式). $\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$
$\stackrel{反应条件1}{→}$H$\stackrel{反应条件2}{→}$I$→_{一定条件下}^{C}$J$\stackrel{还原}{→}$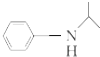
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烷(乙炔):将混合气体通过酸性高锰酸钾溶液,洗气除去乙烷中的乙炔气体 | |
| B. | 苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚 | |
| C. | 酒精(水):向含水酒精中加入生石灰,蒸馏,得到无水酒精 | |
| D. | 硝基苯(NO2):向溶有杂质的硝基苯加入一定量的浓氢氧化钠溶液,振荡,分液可除去中溶解的NO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ③④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com