
| A. | 糖类都能发生水解反应 | |
| B. | 花生油在酸性或碱性条件下发生水解可制得肥皂 | |
| C. | 蛋白质溶液中,加入浓的硫酸铵溶液有沉淀析出,加水后沉淀溶解 | |
| D. | 取适量淀粉溶液于试管中,加入少量稀硫酸,加热3~5min,再冷却,滴加4~6滴氢氧化铜悬浊液,观察有无出现红色沉淀,从而判断淀粉是否发生了水解反应 |
分析 A.单糖不能发生水解反应;
B.油脂在碱性条件下能发生水解反应制得肥皂;
C.浓的硫酸铵能使蛋白质发生盐析现象而析出,但盐析具有可逆性;
D.在加入新制氢氧化铜悬浊液之前必须加入NaOH溶液,否则得不到砖红色沉淀.
解答 解:A.单糖不能发生水解反应,如葡萄糖、果糖等,故A错误;
B.油脂在碱性条件下能发生水解反应制得肥皂,酸性条件下水解生成高级脂肪酸和甘油,故B错误;
C.浓的硫酸铵能使蛋白质发生盐析现象而析出,但盐析具有可逆性,所以盐析后得到的沉淀加水后能溶解,故C正确;
D.在加入新制氢氧化铜悬浊液之前必须加入NaOH溶液,否则新制氢氧化铜悬浊液和稀硫酸反应而得不到砖红色沉淀,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,涉及糖类、蛋白质、油脂、淀粉的性质,明确有机物性质是解本题关键,注意蛋白质盐析和变性的区别,注意D实验滴加溶液先后顺序,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | CO2 | B. | SO2 | C. | NO2 | D. | PM2.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝粉投入到NaOH溶液中:2Al+6H2O+2OH-=2[Al(OH)4]-+3H2↑ | |
| B. | 往Al(OH)3中滴加氨水:Al(OH)3+OH-=[Al(OH)4]- | |
| C. | 向水玻璃中通入少量二氧化碳:SiO32-+CO2+H2O=H2SiO3↓+CO32- | |
| D. | Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-+3H2O=2[Al(OH)4]- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某酸性溶液中只含有Na+.CH3COO-.H+.OH-,向该溶液中加入适量氨水,c(CH3COO-)一定大于c(Na+)与 c(NH4+)之和 | |
| B. | 常温下将0.01molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液.溶液中n(CH3COO-)+n(OH-)-n(H+)=0.006mol | |
| C. | 向硝酸钠溶液中滴加稀盐酸得到的pH=5的混合溶液:c(Na+)<c(NO3-) | |
| D. | 物质的量浓度相等的NaF和NaCN溶液中阴离子总数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5 NA | |
| B. | 26g乙炔所含共价键数目为2 NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | s电子云是球状,而p电子云是哑铃状 | |
| B. | 同一能层中,p能级上的电子比s能级上电子能量高 | |
| C. | 能量高的电子在离原子核较近的区域运动 | |
| D. | 各能级最多容纳电子数是该能级原子轨道数的两倍,其理论依据是泡利不相容原理 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| H2CO3 | K${\;}_{{\;}_{{a}_{1}}}$=4.3×10-7 | HClO | Ka=2.95×10-8 |
| K${\;}_{{a}_{2}}$=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | |||
| 3 | ⑦ | ⑧ | ⑨ | ⑩ | ||||
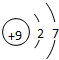 ;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)
;最高价氧化物对应的水化物中碱性最强的是NaOH(填化学式)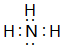 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com