
�ں��º��������£���һ����NO2��N2O4�Ļ������ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ��N2O4(g)
 2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
2NO2(g)����H>0����Ӧ�����и����ʵ����ʵ���Ũ��(c)��ʱ��(t)�ı仯������ͼ��ʾ��
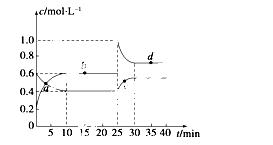
��1�����¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ______________�����¶����ߣ�Kֵ��________(���������С�����䡱)��
��2��a��b��c��d�ĸ����У���ʾ��ѧ��Ӧ����ƽ��״̬����________�㡣����㿪ʼ�״δﵽƽ��ʱ����NO2��ʾ�ķ�Ӧ����Ϊ____________��
��3��25 minʱ��������__________(��������ʵĻ�ѧʽ����������ʵ���)��ʹƽ�ⷢ�����ƶ���
��4��d���ӦNO2�����ʵ���Ũ��________(����ڡ�����С�ڡ����ڡ�)0.8 mol��L��1��������____________________________________________________��

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ԫ�����ڱ�������Ԫ���У�XԪ����Y��Z��W��Ԫ�����ڣ�X��Y��ԭ������֮�͵���Z��ԭ��������������Ԫ��ԭ�ӵ�����������֮��Ϊ20�������ж���ȷ����(����)
A������Ԫ�ص�ԭ�Ӱ뾶��rZ>rX>rY>rW
B��X��Y��Z��W�γɵĵ��������6��
C������Ԫ�ؾ�������Ԫ���γ�18���ӷ���
D������Ԫ���У�Z������������Ӧˮ����������ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£����������ԼΪ1.0L�ĺ����ܱ������з�����Ӧ��
2CH3OH(g) CH3OCH3(g)��H2O(g)
CH3OCH3(g)��H2O(g)
| ���� ��� | �¶ȣ��棩 | ��ʼ���ʵ�����mol�� | ƽ�����ʵ�����mol�� | |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| I | 387 | 0.20 | 0.080 | 0.080 |
| �� | 387 | 0.40 | ||
| �� | 207 | 0.20 | 0.090 | 0.090 |
����˵����ȷ����
A���÷�Ӧ������ӦΪ���ȷ�Ӧ
B���ﵽƽ��ʱ������I�е�CH3OH����������������е�С
C������I�з�Ӧ�ﵽƽ������ʱ����������еij�
D������ʼʱ������I�г���CH3OH 0.1mol��CH3OCH3 0.15mol��H2O 0.10mol����Ӧ��������Ӧ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����̿�����ڴ���������Ⱦ��NO����1 L�ܱ������м���NO�ͻ���̿(������)����������E��F����
�¶ȷֱ���T1 ���T2 ��ʱ�����ƽ��ʱ�����ʵ����ʵ������±���
|
T/�� | ����̿ | NO | E | F |
| ��ʼ | 2.030 | 0.100 | 0 | 0 |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
��1�������ϱ����ݣ�д��NO�����̿��Ӧ�Ļ�ѧ����ʽ��__________________��
��2��������Ӧ��T1 ��ʱ��ƽ�ⳣ��ΪK1����T2 ��ʱ��ƽ�ⳣ��ΪK2��
�ټ���K1��__________________��
�ڸ���������Ϣ�жϣ�T1��T2�Ĺ�ϵ��__________��
a��T1>T2 b��T1<T2 c�����Ƚ�
��3����T1 ���·�Ӧ�ﵽƽ������д�ʩ���ܸı�NO��ת���ʵ���________(�����)��
a������c(NO) b������ѹǿ
c�������¶� d����ȥ����F
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ���¶��£����ݻ�Ϊ2 L���ܱ������з�����ӦCO(g)��H2O(g)  CO2(g)��H2(g)���������ݼ��±�(����t2>t1)��
CO2(g)��H2(g)���������ݼ��±�(����t2>t1)��
| ��Ӧʱ��/min | n(CO) /mol | n(H2O) /mol | n(CO2) /mol | n(H2) /mol |
| 0 | 1.20 | 0.60 | 0 | 0 |
| t1 | 0.80 | |||
| t2 | 0.20 |
����˵����ȷ���� (����)
A����Ӧ��t1 min�ڵķ�Ӧ����Ϊv(H2)�� mol��L��1��min��1
mol��L��1��min��1
B��ƽ��ʱCO��ת����Ϊ66.67%
C�����¶��·�Ӧ��ƽ�ⳣ�� Ϊ1
Ϊ1
D�������������䣬����ʼʱn(CO)��0.60 mol��n(H2O)��1.20 mol����ƽ��ʱn(CO2)��0.20 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����й�˵����ȷ����
A�����ں�������ϸ���һЩͭ�飬����Լ���������ǵĸ�ʴ
B��2NO(g)��2CO(g)=N2(g)��2CO2(g)�ڳ��������Է����У���÷�Ӧ�ġ�H��0
C������0.1mol/LNa2CO3��Һ��CO32����ˮ��̶Ⱥ���Һ��pH������
D�������������Ҵ���������Ӧ����H��0������������Ũ���Ტ���ȣ��÷�Ӧ�ķ�Ӧ���ʺ�ƽ�ⳣ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����ѣ�CH3OCH3������ɫ���壬����Ϊһ��������Դ���ɺϳ��������ΪH2��CO��������CO2��ֱ���Ʊ������ѣ����е� ��Ҫ���̰��������ĸ���Ӧ��
��Ҫ���̰��������ĸ���Ӧ��
�״��ϳɷ�Ӧ��
��i��CO(g) + 2H2(g) = CH3OH(g ) ��H1 = -90.1kJ•mol-1
) ��H1 = -90.1kJ•mol-1
��ii��CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ��H2 = -49.0kJ•mol-1
ˮú���任��Ӧ��
��iii��CO(g) + H2O(g) = CO2(g) + H2 (g) ��H3 = -41.1kJ•mol-1
�����Ѻϳɷ�Ӧ��
��iV��2 CH3OH(g) = CH3OCH3(g) + H2O(g) ��H4 = -24.5kJ•mol-1
�ش��������⣺
��1��Al2O3�Ǻϳ���ֱ���Ʊ������ѷ�Ӧ��������Ҫ�ɷ�֮һ����ҵ�ϴ��������Ʊ��ϸߴ���Al2O3����Ҫ���������� ���Ի�ѧ����ʽ��ʾ����
��2�����������Ѻϳɷ�Ӧ��iV������COת���ʵ�Ӱ�� ��
��3����H2��COֱ���Ʊ������ѣ���һ����Ϊˮ���������Ȼ�ѧ����ʽΪ �����ݻ�ѧ��Ӧԭ������������ѹǿ��ֱ���Ʊ������ѷ�Ӧ��Ӱ�� ��
��4�����о����ڴ�������Cu��Zn��Al��O��Al2O3����ѹǿΪ5.0MPa�������£���H2��COֱ���Ʊ������ѣ��������ͼ��ʾ������COת�������¶����߶����͵�ԭ���� ��

��5��������ֱ��ȼ�ϵ�ؾ��������졢Ч�ʸߵ��ŵ㣬�������ܶȵ��ڼ״�ֱ��ȼ�ϵ�أ�5.93kW•h•kg-1�����������Ϊ���ԣ�������ֱ��ȼ�ϵ�صĸ�����ӦΪ ��һ�������ѷ��Ӿ����绯ѧ���������Բ��� �����ӵ��������õ�ص����������ѹΪ1.20V�������ܶ�E = ����ʽ���㡣�����ܶ�=����������/ȼ��������1 kW•h = 3.6��106J����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
ijѧϰС�������βⶨ��п��Ƥ��п�����������һЩ������
����1.��һ�������Ķ�п��ƤͶ�뵽�����������У�ʹ����ȫ�ܽ⣬ͨ�����������������������Ƥ�ϵ�п��������
����2.��һ�������Ķ�п��Ƥ��W1��Ͷ�뵽������FeSO4��Һ�У�һ��ʱ���ȡ����Ƭ��ϴ������ɡ�������W2����������Ƥ�ϵ�п��������
����3.��һ�������Ķ�п��ƤͶ�뵽�����������У�ʹ����ȫ�ܽ⣬����������Һ�м��������NaOH��Һ�����ˡ�ϴ�ӡ���ɡ����ա���������������
����
��1������2����Ҫ�ص���__________��
����3����Ҫȱ����__________��
��2������1���õ��������������װ�ã���ͼװ���в������ڲ������������װ����������������
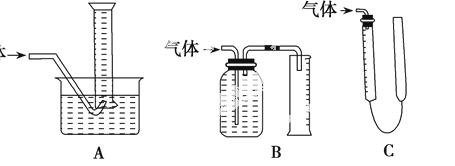
ѧϰС����ѡ��Cװ��������װ�ã��������ռ���ϣ�������ʱ��Ӧע�⣺____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ͼ�ǹ��ڷ�ӦA2(g)+3B2(g)  2C(g)(����ӦΪ���ȷ�Ӧ)
2C(g)(����ӦΪ���ȷ�Ӧ)
��ƽ���ƶ�ͼ�Σ�Ӱ��ƽ���ƶ���ԭ����
A�������¶ȣ�ͬʱ��ѹ
B�������¶ȣ�ͬʱ��ѹ
C������Ӧ��Ũ�ȣ�ͬʱʹ�����˵Ĵ���
 D������Ӧ��Ũ�ȣ�ͬʱ��С������Ũ��
D������Ӧ��Ũ�ȣ�ͬʱ��С������Ũ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com