
| 1 |
| 2 |
| A、m+n>p |
| B、平衡向逆反应方向移动 |
| C、A的转化率增大 |
| D、C的体积分数增加 |


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| A、Cl-一定不存在 |
| B、K+一定存在 |
| C、Mg2+一定存在 |
| D、Ba2+可能存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
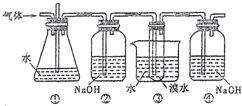 如图是用实验室制得的乙烯(C2H5OH
如图是用实验室制得的乙烯(C2H5OH | 浓硫酸 |
| 170℃ |
| A、装置①和装置③中都盛有水,其作用相同 |
| B、装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C、产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出 |
| D、制备乙烯和生成1,2-二溴乙烷的反应类型分别是消去反应和加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室常用下面装置制备乙稀,请回答下列问题:
实验室常用下面装置制备乙稀,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
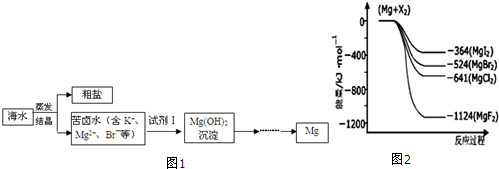
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上合成合成氨的热化学方程式如下:
工业上合成合成氨的热化学方程式如下:查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温高压 |
| 催化剂 |
| A、最终可生成0.2mol NH3 |
| B、使用催化剂不影响反应速率 |
| C、升高温度反应速率增大 |
| D、增大压强反应速率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com