

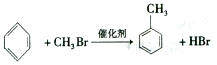
 ;②C物质苯环上一卤代物只有两种.
;②C物质苯环上一卤代物只有两种. .
. $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$
 +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+
 .
.分析 由根据图示转化关系可知,C比甲苯多两个碳原子,结合反应①条件及信息可知:A为乙烯,B为1,2二溴乙烷;因C的苯环上一卤代物只有两种,故两个取代基处于对位,C的结构简式为: ;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为
;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为 ,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为
,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为 ;
;
C一定条件下生成F,F反应生成G为高聚物,由F的分子式可知,C生成F的反应为消去反应,所以F的结构简式为 ,G为
,G为 ,据此进行解答.
,据此进行解答.
解答 解:由根据图示转化关系可知,C比甲苯多两个碳原子,结合反应①条件及信息可知:A为乙烯,B为1,2二溴乙烷;因C的苯环上一卤代物只有两种,故两个取代基处于对位,C的结构简式为: ;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为
;由C与D的分子式可知,应发生卤代烃的水解反应引入羟基,故D为 ,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为
,D发生氧化反应生成E,由D与E的分子式可知,羟基被氧化为羧基,故E为 ;
;
C一定条件下生成F,F反应生成G为高聚物,由F的分子式可知,C生成F的反应为消去反应,所以F的结构简式为 ,G为
,G为 ,
,
(1)根据分析可知,B为BrCH2CH2Br,其名称为:1,2-二溴乙烷;D的结构简式为: ,
,
故答案为:1,2-二溴乙烷; ;
;
(2)反应②为BrCH2CH2Br与甲苯反应生成 和HBr,该反应为取代反应;
和HBr,该反应为取代反应;
反应⑤的化学方程式为: ,则反应条件为:NaOH醇溶液、加热,
,则反应条件为:NaOH醇溶液、加热,
故答案为:取代反应;NaOH醇溶液、加热;
(3)反应⑥为 发生加聚反应生成
发生加聚反应生成 ,反应方程式为n
,反应方程式为n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ ,
,
故答案为:n $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$ ;
;
(4)D为 、E为
、E为 ,二者在浓硫酸作用下加热可以发生酯化反应生成
,二者在浓硫酸作用下加热可以发生酯化反应生成 ,反应的化学方程式为:
,反应的化学方程式为: +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+ ,
,
故答案为: +
+ $→_{△}^{浓硫酸}$H2O+
$→_{△}^{浓硫酸}$H2O+ ;
;
(5)反应②还有可能生成一种C16H18的有机物,应是2分子甲苯与BrCH2CH2Br发生取代反应,其苯环上一卤代物也只有两种,它的结构简式: ,
,
故答案为: ;
;
(6)E为 ,E的同分异构体符合下列条件:
,E的同分异构体符合下列条件:
分子中具有苯环,苯环上含有两个取代基,且能与NaHCO3溶液反应,说明含有羧基,
如果取代基为-COOH、CH3CH2-,有邻间对三种结构;
如果取代基为-CH3、-CH2COOH,有邻间对三种结构,除去E本身,符合条件的有5种,
故答案为:5.
点评 本题考查有机物的推断,题目难度中等,根据反应条件及有机物分子式利用正推法与逆推法相结合进行判断,是对有机物知识的综合考查,能较好的考查学生的阅读、分析与思维能力,是有机热点题型,难点是同分异构体种类确定.


科目:高中化学 来源: 题型:解答题
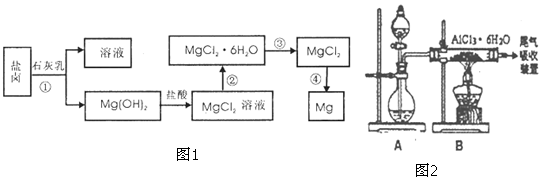
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是一个电化学过程的示意图,请按要求回答下列问题
如图是一个电化学过程的示意图,请按要求回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
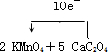
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 磷单质及其化合物有广泛应用.
磷单质及其化合物有广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
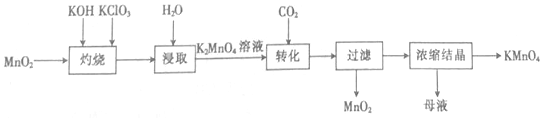
| A. | “灼烧”时,可在玻璃坩埚中进行 | |
| B. | “浸取”时,可用无水乙醇代替水 | |
| C. | “转化”反应中,氧化产物与还原产物的物质的量之比为2:1 | |
| D. | “浓缩结晶”后的母液中只有KMnO4和K2CO3两种溶质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在SO42-、HCO3-、Mg2+,至少存在Na+、K+中的一种 | |
| B. | 为了确定是否存在Cl-,可向溶液中加入硝酸酸化的硝酸银溶液 | |
| C. | c(HCO3-)=0.05mol/L | |
| D. | 4.88g沉淀中含有3种成分 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com