
(13分).巳知 A、B、D为中学常见的单质,甲、乙、丙、丁、戊为短周期元素组成的化合物。其中,丙是一种能使湿润的红色石蕊试纸变蓝的无色气体;丁是一种高能燃料,其组成元素与丙相同,1 mol 丁分子中不同原子的数目比为1 :2,且含有18 mol电子;戊是一种难溶于水的白色胶状物质,既能与强酸反应,也能与强碱反应,具有净水作用。各物质间的转化关系如下图所示(某些条件巳略去)。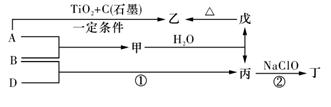
请回答:(1)单质B的组成元素在周期表中的位置是_________。
(2)戊的化学式为________。戊与强碱反应的离子方程式:________________
(3)丙中所包含的化学键类型有________ (填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应①的化学方程式为________________________。
(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为_________
(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为_______________________
(1)第二周期,第ⅤA族;(2)Al(OH)3,Al(OH)3+OH-=AlO2-+2H2O;(3)b;
(4)N2+H2 2NH3;(5)2NH3+NaClO=N2H4+NaCl+H2O;
2NH3;(5)2NH3+NaClO=N2H4+NaCl+H2O;
(6)4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1072KJ/mol
解析试题分析:根据题意可知:A是Al; B是N2;C是H2;甲是AlN;乙是Al2O3;丙的NH3;丁是N2H4;戊是Al(OH)3。(1)单质B的组成元素在周期表中的位置是第二周期,第ⅤA族;(2)戊的化学式为Al(OH)3,戊与强碱反应的离子方程式是:Al(OH)3+OH-=AlO2-+2H2O;(3)在丙NH3中所包含的化学键类型有极性共价键,所以选项是b;(4)反应①的化学方程式为N2+H2 2NH3;(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为2NH3+NaClO=N2H4+NaCl+H2O;(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1072KJ/mol.
2NH3;(5)反应②中,0.5mol NaClO参加反应时,转移1 mol电子,其化学方程式为2NH3+NaClO=N2H4+NaCl+H2O;(6)—定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。巳知,该反应生成1 mol乙时放出536 kJ热量,其热化学方程式为4Al(s)+3TiO2(s)+3C(s)=2Al2O3(s)+3TiC(s) ΔH=-1072KJ/mol.
考点:考查元素及化合物的推断的知识。主要包括元素的位置、物质的化学式的书写、化学方程式、离子方程式、热化学方程式的书写、分子内的化学键的类型的知识。


科目:高中化学 来源: 题型:单选题
中学常见物质A、B、C、D、E、X,存在下图转化关系(部分生成物和反应条件略去)。下列推断不正确的是 
A.若D是一种白色沉淀,在空气中最终变为红褐色,则A可能是铁
B.若D是一种强碱,则A、B、C均可与X反应生成D
C.若D为NaCl,且A可与C反应生成B,则E可能是CO2
D.若D是一种强酸,则A既可以是单质,也可以是化合物,且D可与铜反应生成B或C
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
今有甲、乙、丙、丁、戊5种物质,在一定条件下,它们能按下图方式进行转化: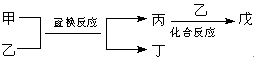
其推断正确的是
| 选项 | 甲 | 乙 | 丙 | 丁 | 戊 |
| A | NH3 | O2 | NO | H2O | NO2 |
| B | Mg | CO2 | C | MgO | CO |
| C | C | H2O | CO | H2 | HCOOH |
| D | FeBr2 | Cl2 | FeCl2 | Br2 | FeCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知X为一种常见酸的浓溶液,能使蔗糖粉末变黑。A与X反应的转化关系如图所示,其中反应条件及部分产物均已略去,则下列有关说法正确的是( )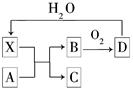
| A.X使蔗糖变黑的现象主要体现了X的强氧化性 |
| B.若A为铁,则足量A与X在室温下即可完全反应 |
| C.若A为碳单质,则将C通入少量的澄清石灰水中,一定可看到白色沉淀 |
| D.工业上,B转化为D的反应条件为高温、常压、使用催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素。在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去)。
请回答下列问题:
(1)若A可用于自来水消毒,D是生产、生活中用量最大、用途最广的金属单质,加热蒸干B的溶液不能得到B,则B的化学式可能是 ;工业上制取A的离子方程式 。
(2)若A是一种碱性气体,常用作制冷剂,B是汽车尾气之一,遇空气会变色,则反应①的化学方程式为 。
(3)若D是氯碱工业的主要产品之一,B有两性,则反应②的离子方程式是 。
(4)若A、C、D都是常见气体,C是导致酸雨的主要气体,则反应③的化学方程式为 。
某同学将搜集到的一定量的酸雨保存在密闭容器中,每隔一定时间测酸雨的pH,发现在起始一段时间内,酸雨的pH呈减小趋势,用离子方程式解释原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有关物质的转化关系如下图所示(部分物质和条件已略去)。B、C、E是常见气体;A、X、Y是常见金属单质,其中Y既能与强酸反应,又能与强碱反应;G的焰色反应显黄色;I的溶液滴加KSCN显血红色。
请回答下列问题:
(1)F的化学式为 。
(2)I的化学式为 。
(3)写出Y和D溶液反应的离子方程式: 。
(4)写出C与H溶液反应的化学方程式,并用双线桥标出电子转移的方向和数目: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图中,A、B、C、D、E是单质,F、G、H、I是B、C、D、E分别和A形成的化合物。已知:①G、H的化学式为“X2Y3”形式,F的化学式为“XY”形式;②I是一种常见的气体,能使澄清石灰水变浑浊,固态I用于人工降雨, E可以在I中燃烧,发生置换反应;③F中的A元素的质量分数为40%。回答问题:

(1)I和E反应的化学方程式为: 。(2分)
(2)C既能与盐酸反应,又能与氢氧化钠溶液反应。C和A形成的化合物H与氢氧化钠溶液反应的离子方程式为: 。(2分)电解H可以制取C, 反应的化学方程式为: 。(2分)
(3)G是一种红棕色粉末,向一定量的G中加入足量硫酸,反应的化学方程式为: 。(2分)向反应后的溶液中加入足量铁粉,反应的离子方程式为: 。(2分)
(4)G与盐酸反应的离子方程式为: 。(2分)得到的溶液中加入铜粉,反应的离子方程式为: 。(2分)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需铜粉 g(3分)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图表示常见元素单质及化合物相应关系,某些生成物已略去。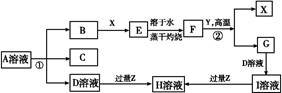
已知:反应①为氯碱工业的基础反应;X、Y为常见金属,Z为形成酸雨的主要成分。请回答下列问题:
(1)D的电子式 ;H为 (填化学式)。
(2)完成下列方程式:
①空气中含量最高的气体与C反应的化学反应方程式 ;
②反应②的化学反应方程式 ;
③足量B通入H溶液的离子反应方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某些化学反应可用下式表示:A+B→C+D+H2O
请回答下列问题(反应可以是固体之间的反应,也可以是在水溶液中进行的反应):
(1)若A是非金属气态单质,反应后所得溶液常用于消毒、杀菌。则A为 (填化学式下同)。反应的化学方程式为 。
(2)若A为非金属固态单质,C、D均为气体且都能使澄清石灰水变浑浊。则A为 。反应的化学方程式为 。
(3)若A为紫红色金属,D为有色气体。则A为 。反应的离子方程式为 。
(4)若A为烧碱溶液,C是相对分子质量为100的白色沉淀,D为正盐。则C为 。反应的离子方程式为 。
(5)若A、B为固体,C的水溶液能使酚酞溶液变为红色。实验室常用此反应制备C气体。则C为 。反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com