
关于次氯酸性质的描述,错误的是( )
|
| A. | 不稳定,易分解放出氧气 | B. | 能使潮湿的有色布条褪色 |
|
| C. | 具有漂白作用和消毒作用 | D. | 是一种比碳酸酸性强的酸 |
考点:
氯、溴、碘及其化合物的综合应用.
分析:
A、次氯酸见光或受热易分解产生氧气和盐酸;
B、次氯酸具有漂白性,能使有色布条褪色;
C、次氯酸具有氧化性,所以具有漂白作用和消毒作用;
D、次氯酸的酸性比碳酸弱.
解答:
解:A、次氯酸见光或受热易分解产生氧气,故A正确;
B、次氯酸因具有氧化性而具有漂白性,能使有色布条褪色,故B正确;
C、次氯酸具有氧化性,所以具有漂白作用和消毒作用,故C正确;
D、根据漂白粉的漂白原理:次氯酸钙和碳酸反应生成次氯酸,由强酸制取弱酸,所以次氯酸的酸性比碳酸弱,故D错误.
故选D.
点评:
本题考查了次氯酸的不稳定性和漂白性,是一道基本知识题目,可以根据已有知识解决.


科目:高中化学 来源: 题型:
某工业废水中可能含有如下几种阴阳离子:
| 阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅱ.若向Ⅰ所得的溶液中加入BaCl2溶液,有白色沉淀生成。
Ⅲ.若向Ⅰ所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出Ⅲ的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)已知用铝粉可以除去废水中的一种阴离子(X)。若控制溶液的pH为10.7左右,再加入铝粉,除去X离子的同时产生氨气和氮气,且体积比为1﹕4,完成下列反应的离子方程式并配平:(X用具体的离子符号表示)
Al + X + OH- =AlO2-+ NH3 + N2 +
该反应的还原产物是 。若除去0.2mol X离子,要消耗铝 g。
(4)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH至少大于 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | ⅠA族元素单质的熔点从上往下逐渐降低 |
|
| B. | 分子晶体中一定存在共价键 |
|
| C. | ⅥA族元素的氢化物中,稳定性最好的其沸点也最高 |
|
| D. | 同周期非金属氧化物对应的水化物的酸性从左往右依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如图1的装置:(以下均假设反应过程中溶液体积不变).
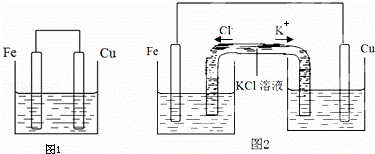
(1)铁片上的电极反应式为 .
(2)铜片周围溶液会出现 的现象.
(3)若2min后测得铁片和铜片之间的质量差为1.2g,计算:
①导线中流过的电子的物质的量为 mol;
②该段时间内用硫酸铜表示的平均反应速率为 mol•L﹣1•min﹣1
(4)若一段时间后测得铁片减少了2.4g,同时铜片增加了3.2g,计算这段时间内该装置消耗的化学能转化为电能的百分比为 .
(5)若将该装置改为如图2所示的装置也能达到和原装置相同的作用.其中KCl溶液起沟通两边溶液形成闭合回路的作用,同时又能阻止反应物直接接触.则硫酸铜溶液应该注入 (填“左侧”、“右侧”或“两侧”)烧杯中.
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有NaBr、KI的溶液中通入过量的Cl2,然后将溶液蒸干,并灼烧固体,最后得到的物质是( )
|
| A. | KCl | B. | NaCl和KCl | C. | NaCl和KBr | D. | NaCl、KCl和I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂排放的工业废水中可能含有K+、Ag+、NH4+、Mg2+、SO42﹣、Cl﹣、NO3﹣、HCO3﹣等离子.经检测废水呈明显的碱性,则可确定该厂废水中肯定不含有的离子组合是( )
|
| A. | Ag+、K+、NO3﹣、HCO3﹣ | B. | K+、NH4+、NO3﹣、SO42﹣ |
|
| C. | Ag+、NH4+、Mg2+、HCO3﹣ | D. | K+、Mg2+、SO42﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
|
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为除去括号内的杂质,所选用的试剂或方法不正确的是
( )
A.Na2CO3溶液(NaHCO3),选用适量的NaOH溶液
B.NaHCO3溶液(Na2CO3),应通入足量的CO2气体
C.Na2O2粉末(Na2O),将混合物在氧气中加热
D.Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的沸点逐渐升高的是( )
|
| A. | NH3 PH3 AsH3 SbH3 | B. | Si SiC H2O CO2 |
|
| C. | NaI NaBr NaCl NaF | D. | Li Na K Rb |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com