
| A. | 丙三醇 | B. | 1,2-丙二醇 | C. | 1,3-丙二醇 | D. | 乙二醇 |
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g C2H4和C3H6的混合物中含有2nA个C原子 | |
| B. | 1 mol Fe与足量稀HNO3反应,转移个2nA个电子 | |
| C. | 1L 0.1 mol/L NaHCO3溶液中含有0.1nA个HCO3- | |
| D. | 常温常压下,22.4L的NO2和CO2混合气体含有2nA个O原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油和水,四氯化碳和水 | B. | 汽油和水,苯和水 | ||
| C. | 食用油和水,醋酸和水 | D. | 葡萄糖和水,酒精和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
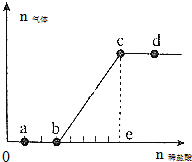 向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )
向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示.下列有关说法中正确的是( )| A. | a点对应的溶液中c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| B. | b,c段反应的离子方程式为HCO${\;}_{3}^{-}$+H+═H2O+CO2↑ | |
| C. | 原溶液中n(NaCO3)=n(NaHCO3) | |
| D. | K+、NO${\;}_{3}^{-}$、SiO${\;}_{3}^{2-}$可大量存在于d点对应的溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
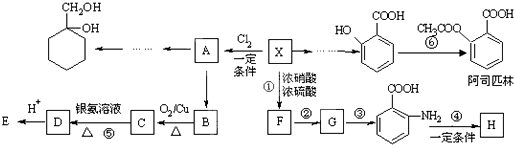
 Ⅱ
Ⅱ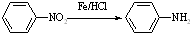 (苯胺,易被氧化)
(苯胺,易被氧化)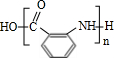 ;
;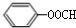 +2NaOH→
+2NaOH→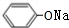 +HCOONa+H2O.
+HCOONa+H2O.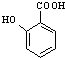 有多种同分异构体,其中含符合下列条件的共有2种.
有多种同分异构体,其中含符合下列条件的共有2种.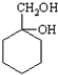 的过程.
的过程.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 量取10mL该溶液倒入试管中,试管中,试管中Na+的物质的量为0.08mol | |
| B. | 该溶液的物质的量浓度为0.8mol•L-1 | |
| C. | 该溶液中含有46.8g NaCl | |
| D. | 配置50mL该溶液需用23.4g NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
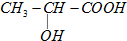 )及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下:
)及其盐广泛应用于食品、医药、化工等领域.有一种制备乳酸方法如下: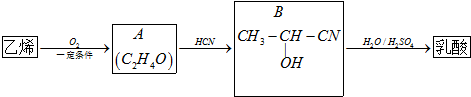
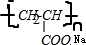 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com