
【题目】氢气是一种常用的化工原料,如合成氨和尿素[CO(NH2)2]等。
(1)以H2合成CO(NH2)2的有关热化学方程式有:
①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
则N2(g)、H2(g)与CO2(g)反应生成CO(NH2)2(s)和H2O(l)的热化学方程式为_______________________________________________________。
(2)电解制H2的原理为C(s)+2H2O(l)![]() CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
CO2(g)+2H2(g)。某学习小组拟以二甲醚(CH3OCH3)-空气碱性燃料电池为电源,电解煤浆液(由煤粉与稀硫酸组成)探究上述原理,装置如图所示。
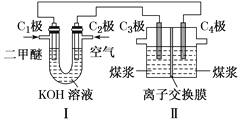
①分别写出电极C1和C3的电极反应式__________________;___________________。
②离子交换膜可能是________(填字母)。
a.阳离子交换膜 b.阴离子交换膜 c.质子交换膜
③已知4.6 g二甲醚参与反应,假设装置Ⅰ的能量转化率为100%,C4极收集到11.2L(标准状况)气体,装置Ⅱ的电流效率η=________。![]()
【答案】 N2(g)+3H2(g)+CO2(g)===CO(NH2)2(s)+H2O(l) ΔH=-179.3 kJ·mol-1 CH3OCH3+16OH--12e-==2CO![]() +11H2O C-4e-+2H2O===CO2↑+4H+ ac 83.3%
+11H2O C-4e-+2H2O===CO2↑+4H+ ac 83.3%
【解析】(1)已知:①N2(g)+3H2(g)===2NH3(g)ΔH1=-92.4 kJ·mol-1
②NH3(g)+![]() CO2(g)===
CO2(g)===![]() NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
NH2CO2NH4(s)ΔH2=-79.7 kJ·mol-1
③NH2CO2NH4(s)===CO(NH2)2(s)+H2O(l)ΔH3=+72.5 kJ·mol-1
根据盖斯定律,由①+②×2+③得反应N2(g)+3H2(g)+CO2(g)=CO(NH2)2(s)+H2O(l) ΔH=ΔH1+ΔH2×2+ΔH3=-92.4 kJ·mol-1-79.7 kJ·mol-1×2+72.5 kJ·mol-1=-179.3 kJ·mol-1;(2)①燃料电池中二甲醚(CH3OCH3)的一极为电池的负极,二甲醚在碱性条件下失电子产生碳酸根离子,故电极C1的电极反应式为CH3OCH3+16OH--12e-==2CO![]() +11H2O;C2为电池的正极,连接正极的C3为电解池的阳极,根据电解制H2的原理C(s)+2H2O(l)
+11H2O;C2为电池的正极,连接正极的C3为电解池的阳极,根据电解制H2的原理C(s)+2H2O(l)![]() CO2(g)+2H2(g)可知,C3电极电解煤浆液(由煤粉与稀硫酸组成)碳失电子产生二氧化碳,电极反应式为C-4e-+2H2O===CO2↑+4H+;②离子交换膜是允许氢离子通过,保证产生的氢气和二氧化碳分开,故可能是阳离子交换膜或质子交换膜,答案选ac;③装置Ⅰ中负极反应式为CH3OCH3+16OH--12e-==2CO
CO2(g)+2H2(g)可知,C3电极电解煤浆液(由煤粉与稀硫酸组成)碳失电子产生二氧化碳,电极反应式为C-4e-+2H2O===CO2↑+4H+;②离子交换膜是允许氢离子通过,保证产生的氢气和二氧化碳分开,故可能是阳离子交换膜或质子交换膜,答案选ac;③装置Ⅰ中负极反应式为CH3OCH3+16OH--12e-==2CO![]() +11H2O,n(CH3OCH3)=
+11H2O,n(CH3OCH3)= ![]() ,装置Ⅰ向装置Ⅱ提供的电子的物质的量为
,装置Ⅰ向装置Ⅱ提供的电子的物质的量为![]() ;n(H2)=
;n(H2)= ![]() ,生成0.5mol氢气需要电子的物质的量为1mol,根据电流效率定义,装置Ⅱ的电流效率η=
,生成0.5mol氢气需要电子的物质的量为1mol,根据电流效率定义,装置Ⅱ的电流效率η=![]() 。
。


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其反应原理如图所示。下列说法不正确的是
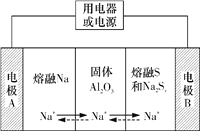
A. 放电时,电极A为负极,Na+由A极向B极移动
B. 该电池不能在常温下工作
C. 充电时,电极B连接外电源的负极
D. 放电时,B极的电极反应式为xS+2e-===S![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钠及其化合物的说法正确的是( )
A.将剩余的金属钠丢弃在废纸篓里
B.小苏打可用于制作糕点的膨松剂,苏打可用于治疗胃酸过多
C.侯氏制碱法的工艺过程中应用了物质溶解度的差异
D.生活中用热的烧碱溶液洗去油污
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
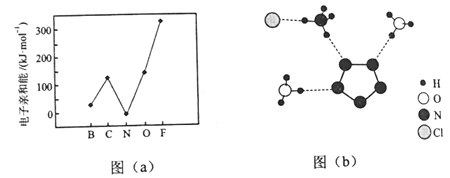
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质属于原子晶体的是( )
A. 熔点是1070℃,易溶于水,水溶液能导电
B. 熔点是10.31℃,液态不导电,水溶液能导电
C. 不溶于水,熔点3550℃,不导电
D. 熔点是97.80℃,质软、导电,密度是0.97gcm-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当溶液中XO42- 和SO32-的离子数目之比为1∶2时,恰好完全反应,则X元素在还原产物中的化合价为( )
A.+1
B.+2
C.+3
D.+4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Al(SO4)2是一种食品添加剂,用于焙烤食品;NH4HSO4在分析化学、制药工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是___________________________________________________ (用必要的化学用语和相关文字说明)。
(2)相同温度下,浓度均为0.1 mol/L 的下列溶液中的c(![]() )由大到小_____(填序号)。
)由大到小_____(填序号)。
①NH4Al(SO4)2 ②CH3COONH4 ③ NH4HSO4 ④NH3·H2O ⑤NH4Cl
(3)如图1是0.1 mol/L电解质溶液的pH随温度变化的图像。其中符合0.1 mol/L NH4Al(SO4)2溶液的pH随温度变化的曲线是_____(填写字母)。
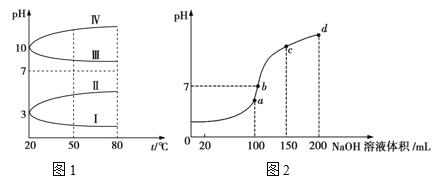
(4)室温时,向100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是_____;在b点,溶液中各离子浓度由大到小的排列顺序是______;在cd段发生反应的离子方程式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
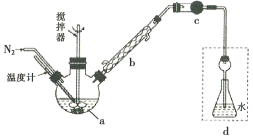
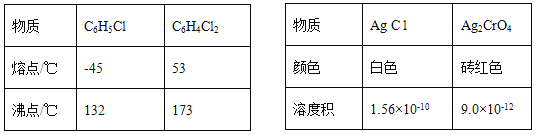
【题目】莫尔法是用硝酸银标准溶液测定卤离子含量的沉淀滴定法。将无水FeCl3与氯苯混合发生反应:2FeCl3 +C6H5Cl ![]() 2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
2FeCl3+C6H4C12+HC1↑,将生成的HC1用水吸收,利用莫尔法测出无水FeCl3的转化率,同时得到常用的还原剂FeCl2,按照如图装置,在三颈烧瓶中放入162.5g无水FeCl3与225g氯苯,控制反应温度在130℃下加热3h,冷却、过滤、洗涤、干燥得到粗产品。有关数据如下:
回答下列问题:
(1)仪器a的名称是________,搅拌器的作用是_______。
(2)反应结束后,还要继续通入N2的目的是__________;仪器c盛装的试剂是________(填序号)。
A.碱石灰 B.浓硫酸 C.无水氯化钙 D.硅胶
(3)如何从滤液中回收过量的氯苯:_____________
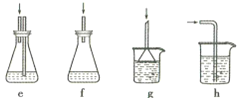
(4)下列各装置(盛有蒸馏水)能代替图中虚线框内部分的是_________(填序号)。
(5)将锥形瓶内的溶液稀释至1000mL,从中取10. 00mL,用0. 2000mol·L-1AgNO3溶液进行滴定,以K2CrO4溶液作指示剂,终点现象为______;若消耗22.50mL AgNO3溶液,则无水FeCl3的转化率为_____。
(6)上述滴定完成时,若滴定管尖嘴处留有气泡会导致测定结果偏_______(填“高”或“低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有21.6 g由CO和CO2组成的混合气体,在标准状况下其体积为13.44 L。回答下列问题:
(1)该混合气体的平均摩尔质量为________。
(2)混合气体中碳原子的质量为________。

(3)将混合气体依次通过如图所示装置,最后收集在气球中(实验在标准状况下测定)。
①气球中收集到的气体的摩尔质量为________。
②气球的体积为________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com