
【题目】铜及其化合物在生产生活中有广泛应用
(1)工业上以黄铜矿(CuFeS2)为原料,采用火法熔炼工艺生产铜的中间过程会发生反应:2Cu2O+Cu2S![]() 6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
6Cu+SO2↑该反应的氧化剂是________________,验证SO2的方法是________________。
(2)将少量铜丝放入适量的稀硫酸中,温度控制在50℃,加入H2O2,反应一段时间后,升温到60℃,再反应一段时间后可制得硫酸铜。温度控制在50℃~60℃的原因有:①加快反应速率;②___________。在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,可生成CuC1沉淀,写出生成CuCl的离子方程式______________。
(3)碱式碳酸铜在有机催化剂、烟火制造和颜料、农药生产中有广泛的应用。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备碱式碳酸铜的流程如下:
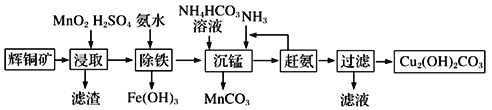
①辉铜矿在浸取前要富集与粉碎,粉碎的好处是___________。
②浸取过程中可得到一种黄色单质,写出浸取时主要反应的化学方程式___________。
③“除铁”这一步反应在25℃进行,加入氨水调节溶液pH为4后,溶液中铜离子最大浓度不超过_________mol/L。(已知Ksp[Cu(OH)2]=2.2×10-20)
【答案】Cu2S和Cu2O将气体通入品红溶液,溶液褪色,加热恢复原色防止H2O2分解2Cu2++2Cl-+SO32-+H2O![]() 2CuCl↓+ SO42-+2H+可提高浸取速率和浸取率Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O2.2
2CuCl↓+ SO42-+2H+可提高浸取速率和浸取率Cu2S+2MnO2 +4H2SO4= 2CuSO4+S+2MnSO4+4H2O2.2
【解析】
(1)2Cu2O+Cu2S=6Cu+SO2中,Cu元素化合价由+1价降低到0价,硫元素化合价由-2价升高为+4价,所以氧化剂为Cu2O、Cu2S;验证SO2的方法是将气体通入品红溶液,溶液褪色,加热恢复原色;(2)温度过高,过氧化氢易分解,所以为了防止过氧化氢分解,将温度控制在一定范围内;在CuSO4溶液中加入一定量的Na2SO3和NaCl溶液加热,生成CuCl沉淀,Cu的化合价降低,则S的化合价升高,所以产物中有硫酸根离子生成,所以反应的离子方程式为2Cu2++2Cl-+SO32-+H2O![]() 2CuCl↓+ SO42-+2H+;(3)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:
2CuCl↓+ SO42-+2H+;(3)①酸浸时,通过粉碎矿石或者升高温度或者进行搅拌或都增加酸的浓度,都可以提高浸取速率;②反应物是二氧化锰、硫化铜和硫酸,生成物是S、硫酸铜、硫酸锰,反应的方程式为2MnO2+Cu2S+4H2SO4=S↓+2CuSO4+2MnSO4+4H2O;③溶液pH=4,c(OH-)=10-10mol/L,则稀释后的溶液中铜离子浓度最大不能超过:![]() mol/L=2.2 mol/L。
mol/L=2.2 mol/L。


科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式的是
A. 氢氧化钡溶液与硫酸的反应:OH-+H+===H2O
B. 澄清的石灰水与稀盐酸反应:Ca(OH)2+2H+===Ca2++2H2O
C. 铜片插入硝酸银溶液中:Cu+Ag+===Cu2++Ag
D. 碳酸钙溶于稀盐酸中:CaCO3+2H+="==" Ca2++H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外, 曾主要用于造币,亦可用于制作仿银饰品。回答下列问题:
(1)镍元素基态原子的电子排布式为_____。
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4 蓝色溶液。
① [Ni(NH3)6]SO4中 H、N、O 元素的电负性由大到小的顺序为_____;SO42-的立体构型是_________;与 SO42-互为等电子体的微粒为_____(填化学式,任写一种)。
② 氨的沸点高于膦(PH3),原因是______; 氨是_____分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 。
(3)元素铜与镍的第二电离能分别为:ICu=1959kJ/mol ,INi=1753kJ/mol ,第二电离 ICu>INi 的原因是____________。
(4)铜的某种氯化物不仅易溶于水,而且易溶于乙醇和丙酮,其链状结构如图所示,则该氯化物的 化学式为____________________,属于_____晶体。

(5)Cu2+与乙二胺可形成上右图所示配离子,其中所含化学键类型有 ____(填标号)。
a.配位键 b.极性键 c.离子键 d.非极性键 e.金属键
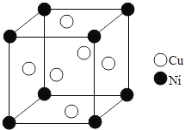
(6)某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A. 1 L 1 mol·L-1的NaHCO3 溶液中含有HCO3-的数目为NA
B. 78 g 苯含有C=C 双键的数目为3NA
C. 常温常压下,6. 72 L NO2与水充分反应转移的电子数目为0. 1NA
D. 冰醋酸和葡萄糖的混合物30g含有碳原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.10 mol·L-1的盐酸滴定20.00 mL 0.10 mol·L-1的某碱BOH溶液得到的滴定曲线如图,下列判断不正确的是
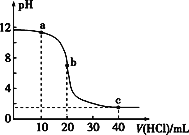
A. a点时,溶液呈碱性,溶液中c(B+)>c(Cl-)
B. b点时溶液的pH=7
C. 当c(Cl-)=c(B+)时,V(HCl)<20 mL
D. c点时溶液中c(H+)约为0.033 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】夏日的夜晚,常看见儿童手持发光的“魔棒”在广场上嬉戏。“魔棒”发光原理是利用过氧化氢氧化草酸二酯产生能量,该能量被传递给荧光物质后便发出荧光,草酸二酯(CPPO)结构简式如图。已知:苯环上卤素不水解,下列有关说法不正确的是
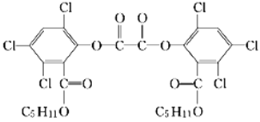
A. 草酸二酯的分子式为C26H24Cl6O8
B. 该有机物能发生加成反应、取代反应、氧化反应
C. 1 mol草酸二酯与氢气完全反应,需要氢气6 mol
D. 1 mol草酸二酯与氢氧化钠稀溶液反应,最多消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.同周期元素核电荷数越大,最外层电子数越多
B.最外层电子数越多,原子半径越小
C.从11~17号元素原子的半径逐渐增大
D.核电荷数越大,原子半径越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三届联合国环境大会的主题为“迈向零污染地球”。下列做法不应提倡的是( )
A. 推广电动汽车,践行绿色交通 B. 回收电子垃圾,集中填埋处理
C. 水果保鲜,可用浸泡过高锰酸钾溶液的硅土 D. 净化工业尾气,减少雾霾生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com