
| A、草酸氢钾溶液呈酸性,在0.1mol?L-1 KHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| B、在小苏打水溶液中:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) |
| C、相同温度下,1mol?L-1氨水溶液与0.5mol?L-1氨水溶液中,c(OH-)之比是2:1 |
| D、当氨水与盐酸恰好完全反应时,c(NH4+)>c(Cl-)>c(H+)>c(OH-) |


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
| A、氧化剂 |
| B、还原剂 |
| C、既是氧化剂又是还原剂 |
| D、既不是氧化剂又不是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CaCO3 |
| B、Mg |
| C、NaHCO3 |
| D、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度(K) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1 173 | 2.15 | 1.67 |
| A、反应①是放热反应 |
| B、反应②是放热反应 |
| C、反应②在973K时增大压强,K2增大 |
| D、在常温下反应①一定能自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
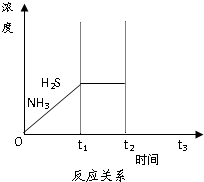 脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.
脱硫天然气中的硫化氢既能减少环境污染,又可回收硫资源.查看答案和解析>>
科目:高中化学 来源: 题型:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com