
【题目】工业上采用乙苯与CO2脱氢生产重要化工原料苯乙烯  (g)+CO2(g)
(g)+CO2(g) 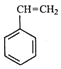 (g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.
(g)=CO(g)+H2O(g)△H,其中乙苯在CO2气氛中的反应可分两步进行 A.  (g)
(g)  (g)+H2(g)△H1=﹣125KJ/mol
(g)+H2(g)△H1=﹣125KJ/mol
B.H2(g)+CO2(g)CO(g)+H2O(g)△H2=﹣41KJ/mol
(1)上述乙苯与CO2反应的反应热△H为
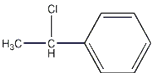
(2)苯乙烯与HCl加成的产物中具有手性异构体的分子的结构简式为 .
(3)在3L密闭容器内,乙苯与CO2的反应在三种不同的条件下进行实验,乙苯、CO2的起始浓度分别为1.0mol/L和3.0mol/L,其中实验I在T1℃,0.3MPa,而实验II、III分别改变了实验其他条件;乙苯的浓度随时间的变化如图I所示. 
①实验I乙苯在0﹣50min时的反应速率为
②实验Ⅱ可能改变条件的是
③图II是实验I中苯乙烯体积分数V%随时间t的变化曲线,请在图II中补画实验Ⅲ中苯乙烯体积分数V%随时间t的变化曲线.
(4)25℃时,将体积为Va PH=a的某一元强碱与体积为Vb PH=b的某二元强酸混合.若所得混合溶液的pH=11,且a=13,b=2,则Va:Vb= .
【答案】
(1)﹣166KJ/mol
(2)
(3)0.012mol/(L?min);加催化剂
(4)1:9
【解析】解:(1)方程A+方程B得到: 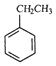 (g)+CO2(g)
(g)+CO2(g) 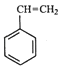 (g)=CO(g)+H2O(g)△H,所以该反应的反应热为:△H=△H1+△H2=﹣125﹣41=﹣166KJ/mol,
(g)=CO(g)+H2O(g)△H,所以该反应的反应热为:△H=△H1+△H2=﹣125﹣41=﹣166KJ/mol,
所以答案是:﹣166KJ/mol;(2)苯乙烯与HCl加成的产物中具有手性异构体的分子即Cl加到H少的那个碳上,则结构简式为 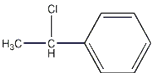 ,所以答案是:
,所以答案是:  ;(3)①根据图I中可知,0﹣50min时乙苯的浓度变化为1.0mol/L﹣0.4mol/L=0.6mol/L,则其反应速率为v=
;(3)①根据图I中可知,0﹣50min时乙苯的浓度变化为1.0mol/L﹣0.4mol/L=0.6mol/L,则其反应速率为v= ![]() =
= ![]() =0.012mol/(Lmin);
=0.012mol/(Lmin);
所以答案是:0.012mol/(Lmin);
②根据图I中实验Ⅱ改变条件平衡不移动,而反应速率增大,所以改变的条件是加催化剂,所以答案是:加催化剂;
③实验Ⅲ中改变条件,由图I可知乙苯的浓度增大,平衡逆移,所以苯乙烯体积分数V%随时间t增大而减小,其图形为:  ;
;
所以答案是:  ;(4)pH=13的强碱溶液中c(OH﹣)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,所得溶液pH=11,混合溶液呈碱性,溶液中c(OH﹣)=0.001mol/L,设酸溶液体积为x,碱溶液体积为y,则:
;(4)pH=13的强碱溶液中c(OH﹣)=0.1mol/L,pH=2的强酸溶液中c(H+)=0.01mol/L,所得溶液pH=11,混合溶液呈碱性,溶液中c(OH﹣)=0.001mol/L,设酸溶液体积为x,碱溶液体积为y,则: ![]() =0.001mol/L,解得y:x=1:9,即Va:Vb=1:9,
=0.001mol/L,解得y:x=1:9,即Va:Vb=1:9,
所以答案是:1:9.
【考点精析】认真审题,首先需要了解化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%).


科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色晶体,极微溶于水,不溶于醇类。可与水缓慢反应,易与酸反应。实验室通常用CaCl2在碱性条件下与H2O2反应制得(该反应剧烈并大量放热),装置如图所示,请回答下面的问题:
I.CaO2的制备

(1)漏斗在使用时其上口的玻璃塞应________(填“打开”或“关闭”),支管B的作用是________。
(2)将盛有浓CaCl2溶液的装置置于冰水混合物中。其原因是:使反应平稳进行、___________。
(3)加入H2O2与浓氨水的混合溶液,使反应开始。
①反应的化学方程式是_______________。
②滴加H2O2与浓氨水混合溶液之前,还应进行的操作是______。
(4)待反应结束后,经______(填操作)得CaO2粗产品。
Ⅱ.CaO2纯度的测定:将一定量的CaO2溶于稀硫酸,用标准KMnO4溶液滴定生成的H2O2(KMnO4反应后生成Mn2+),计算确定CaO2的含量。
(5)现每次称取0.4000g样品溶解后,用0.1000mol/L的KMnO4溶液滴定,所得的数据如下表所示,则样品的纯度__________。
实验序号 | ① | ② | ③ | ④ |
消耗KMnO4体积/mL | 19.98 | 20.02 | 20.20 | 20.00 |
(6)测得CaO2样品的纯度偏低,其原因可能是______(选填编号)。
A.烘烤时间不足
B.配制KMnO4标准溶液定容时俯视容量瓶刻度线
C.在洁净干燥的酸式滴定管中未润洗即装标准液
D.滴定前尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不能与CO2发生反应的是( )。
①Na2O ②Na2O2 ③NaCl ④NaOH ⑤NaHCO3
A.①④B.②③C.③⑤D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)写出与H2O分子互为等电子体的一种阴离子的化学式为 .
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)向CuSO4溶液中滴加氨水,先产生蓝色沉淀,然后沉淀溶解,溶液呈深蓝色.请写出生成配合离子的离子方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:
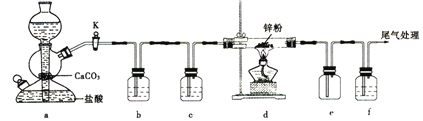
下列叙述正确的是
A. 装置e的作用是防倒吸
B. 如图所示装置的活塞K处于关闭状态
C. 实验结束时,先关闭活塞K,再熄灭酒精灯
D. b、c、f中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨气能被氯气氧化成N2,化工厂常用浓氨水检验管道是否泄漏氯气。某兴趣小组在实验室对氨气与氯气反应进行了探究,回答下列问题:
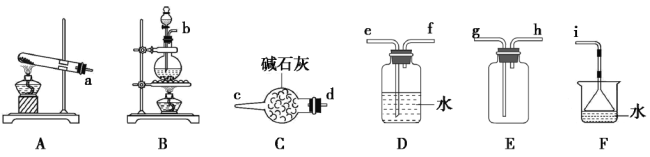
(1)氯气的发生装置可以选择上图中的_________(填大写字母),反应的离子方程式为________________。
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→________(按气流方向,用小写字母表示)。
II.氯气与氨气的反应
室温下,用收集到的氯气与氨气按下图所示装进行实验(实验前K1、K2关闭)。

(3)为使两种气体充分混合,气体a是___________(填化学式)。
(4)
操作步骤 | 实验现象 | 解释原因 |
打开K1,缓缓推动注射器活塞,向试 管中注入气体a (约是气体b的3倍), 关闭K1,恢复室温 | 试管内出现白烟并在 试管内壁凝结 | ①反应的化学方程式________ |
打开K2 | ②_________ | ③_________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途具有对应关系的是
A.明矾易溶于水,可用作净水剂
B.Al2O3熔点高,可用于制作耐火材料
C.HClO具有弱酸性,可用于漂白、消毒
D.Al(OH)3高温会分解,可用于治疗胃酸过多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中进行的可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g),下列能判断该反应已经达到化学平衡状态的是( )
2SO3(g),下列能判断该反应已经达到化学平衡状态的是( )
A.SO2、O2、SO3的浓度相等
B.SO2、O2、SO3的浓度不再发生变化
C.SO2、O2、SO3在密闭容器中共存
D.反应停止,正、逆反应速率都等于零
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光催化技术是一种在能源和环境领域有着重要应用前景的绿色技术。Ti的某种晶型的氧化物M可用作光催化材料。
(1)基态Ti原子的价层电子排布图为________。
(2)在第四周期d区元素中,与Ti 原子未成对电子数相同的元素名称是________。
(3)金属钛的原子堆积方式如图1所示,则金属钛晶胞俯视图为_____。

(4)生活环境中的臭气源有氨气、甲硫醇(CH3-SH) 等,M 可以作为高效除臭剂。与氨气互为等电子体的阳离子为_____,甲硫醇中硫原子采取的杂化方式为_____,与S位于同一周期,且第一电离能小于S 的非金属元素符号为______,已知甲硫醇熔沸点小于甲醇(CH3OH),试解释此差异的主要原因___________。
(5)M 的晶胞结构如图2,M 化学式为______。
(6)石墨烯是单个原子厚度的二维碳纳米材料( 如图3),其比表面积大( 比表面积指单位质量物料所具有的总面积)。石墨烯与M 的结合使用,极大地提高了M 的光催化效果。在石墨烯晶体中,每个最小的六元环占有____个C 原子。已知石墨烯中C-C 键长为a pm,则单层石墨烯的比表面积为_____m2/g(NA表示阿伏伽德罗常数的数值,忽略碳原子的厚度)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com