
【题目】某研究性学习小组欲测定室温下(25℃,101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
①配制 100 mL 1.0mol/L的盐酸溶液:.
②用_______________(填仪器名称并注明规格)量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③称取ag已除去表面氧化膜的镁条,并系于铜丝未端,为使HCl全部参加反应,a的数值至少为__________;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为91.9mL
请将上述步骤补充完整并回答下列问题。
(1)步骤①中所需要带刻度的仪器为__________,若用36.5%的浓盐酸(密度为1.20g/mL)
进行稀释配制,则需要量取该浓盐酸___________mL
(2)步骤①中,配制100 mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低___________(填写字母).
A.用量筒量取浓盐酸时,俯视量筒的刻度
B.容量瓶未干燥即用来配制溶液.
C.未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后;发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线.
F.烧杯中有少量水.
(3)请填写操作步骤中的空格:步骤②_________步骤③_______________
(4)实验步骤5中应选用______________(填字母)的量筒。.'
A.100 mL B.200mL C.500mL
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=_____________L/mol(保留2位小数)
【答案】10mL量筒 0.09g 量筒 8.3mL AC 10mL量筒 0.09g A 24.51mol/L
【解析】
(1)步骤①配制过程中所需要的玻璃仪器有量筒、烧杯、100 mL容量瓶、胶头滴管、玻璃棒,其中需要带刻度的仪器为量筒;
36.5%的浓盐酸(密度为1.20g/mL)的物质的量浓度c=![]() =
=![]() =12mol/L,溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀)计算,设需浓盐酸VL,0.10L×1.0mol/L=12.0mol/L×VL;V=0.0083L=8.3mL;
=12mol/L,溶液稀释前后溶质的物质的量不变,则有c(浓)×V(浓)=c(稀)×V(稀)计算,设需浓盐酸VL,0.10L×1.0mol/L=12.0mol/L×VL;V=0.0083L=8.3mL;
(2)A.用量筒量取浓盐酸时,俯视量筒的刻度会使所量取溶液的体积减小,时所配置的溶液的浓度偏小,选项A符合;
B.容量瓶未干燥即用来配制溶液对所配置的溶液的浓度没有影响,选项B不符合;
C.未洗涤烧杯和玻璃棒,则n偏小,会使配制浓度偏低,选项C符合;
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线不会对所配置的溶液的浓度有影响,选项D不符合;
E.在容量瓶中定容时俯视容量瓶刻度线,会使容量瓶中的液体的体积偏小,所配置的溶液浓度偏大,选项E不符合;
F.烧杯中有少量水对配置的溶液的浓度无关,选项F不符合;
故答案为AC;
(3)步骤②量取7.5mL 1.0mol/L的盐酸溶液加入锥形瓶中,题中要求酸的体积7.5mL,故选用10mL量筒即可;
步骤③
Mg+2HCl═MgCl2+H2↑
1mol 2mol
n 0.0075 mol
n=0.00375mol,故a=24g/mol×0.00375mol=0.090g;
故答案为:10mL量筒;0.09g;
(4)Mg+2HCl═MgCl2+H2↑
2mol 1mol
0.0075 mol n(H2)
n(H2)=0.00375mol,V(H2)=0.00375 mol×22.4L/mol=0.056L=56ml,应选100mL量筒;
故答案为:A;
(5)由步骤③得气体的物质的量为0.00375mol,气体的体积为91.9mL mL,Vm=![]() =
=![]() =24.51L/mol;
=24.51L/mol;
故答案为:24.51mol/L。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下,ag气体A与bg气体B的分子数相同,则与此有关的以下说法中不正确的是
A.气体A与气体B的摩尔质量之比为![]()
B.相同状况下,同体积的气体A与气体B的质量之比为![]()
C.质量相同的气体A与气体B的分子数之比为![]()
D.同温同压下,气体A与气体B的密度之比为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用向上排空气法收集一试管的氯气,经测定其密度为相同条件下氢气密度的 26.5倍。将该试管倒立在水槽中,当日光照射相当长一段时间后,试管中最后剩余的气体体积约占试管容积的( )
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 4 mol A 气体和 2 mol B 气体在 2 L 的定容容器中混合并在一定条件下发生如下反应 2A(g)+B(g)![]() 2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:
2C(g) △H<0 ,经 2 s(秒)后测得 C 的浓度为 0. 6 mol·L-1 ,现有下列几种说法:
① 用物质 A 表示的反应的平均速率为 0.3 mol·L-1s-1
② 达到平衡状态时,升高温度,则该化学平衡向左移动,同时化学平衡常数K也减小
③ 2 s 时物质 A 的转化率为70%
④ 达到平衡状态时,增加A物质的量,A和B转化率都提高
⑤当各物质浓度满足c(A)=2c(B)= c(C)时,该反应达到了平衡状态
其中正确的是( )
A. ①③ B. ①② C. ②③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按下图装置进行实验,并回答下列问题:

(1)判断装置的名称:A池为___________ ;B池为______________;
(2)锌极为________极,电极反应式为___________________________________;铜极为________极,电极反应式为___________________________________;石墨棒C1为______极,电极反应式为__________________________________;石墨棒C2附近发生的实验现象为______________________________________;
(3)当C2极析出224mL气体(标准状态)时,锌的质量变化_________(变大、不变或变小)了________g,CuSO4溶液的质量_________(增加、不变或减少)_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中如图所示的一些物质或概念间的从属关系,不正确的是
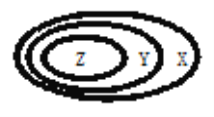
Z | Y | X | |
A | 氧化物 | 化合物 | 纯净物 |
B | 非电解质 | 电解质 | 化合物 |
C | 胶体 | 分散系 | 混合物 |
D | 碱性氧化物 | 金属氧化物 | 氧化物 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列内容与结论相对应的是
选项 | 内容 | 结论 |
A | H2O(g)变成H2O(l) | △S>0 |
B | 硝酸铵溶于水可自发进行 | 因为△S>0 |
C | 一个反应的△H>0,△S>0 | 反应一定不自发进行 |
D | H2(g)+F2(g)=2HF(g),△H=-271kJ/mol △S=8J/(mol·K) | 反应在任意外界条件下均可自发进行 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知图一表示的是可逆反应CO(g)+H2(g) ![]() C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g)
C(s)+H2O(g) ΔH>0的化学反应速率(v)与时间(t)的关系,图二表示的是可逆反应2NO2(g) ![]() N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是
N2O4(g) ΔH<0的浓度(c)随时间t的变化情况。下列说法中正确的是

A.图一t2时改变的条件可能是升高了温度或使用了催化剂
B.若图一t2时改变的条件是增大压强,则反应的ΔH增大
C.图二t1时改变的条件可能是升高了温度或增大了压强
D.若图二t1时改变的条件是增大压强,则混合气体的平均相对分子质量将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是生产塑料和合成橡胶的重要基本有机原料,乙苯催化脱氢法是目前国内外生产苯乙烯的主要方法,其化学方程式为:
![]()
(1)若升高温度,该反应的平衡常数变大,则ΔH_______0(填“大于”或“小于”)。该反应在_______________条件下能自发进行。
(2)维持体系总压强ρ恒定,在温度T时,物质的量为2mol、体积为1L的乙苯蒸汽发生催化脱氢反应。已知乙苯的平衡转化率为80%,则在该温度下反应的平衡常数K=_____。
(3)在体积为2L的恒温密闭容器中通入2mol乙苯蒸汽,2分钟后达到平衡,测得氢气的浓度是0.5mol/L,则乙苯蒸汽的反应速率为_________________;维持温度和容器体积不变,向上述平衡中再通入1mol氢气和1mol乙苯蒸汽,则v正_______v逆(填“大于”、“小于”或“等于”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com