
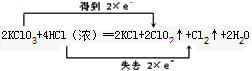
 .
.分析 (1)KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-;
(2)HCl中Cl元素的化合价升高,具有还原性,生成盐表现酸性;
(3)由反应可知,生成1molCl2时,转移2mol电子,以此计算.
解答 解:(1)KClO3中Cl元素由+5价降低为+4价,HCl中Cl元素由-1价升高为0,反应中转移2e-,则双线桥表示反应中电子转移的方向和数目
为 ,故答案为:
,故答案为: ;
;
(2)由反应可知,HCl中部分Cl元素的化合价升高,体现还原性,部分化合价不变生成盐表现酸性,故答案为:②;
(3)由反应可知,生成1molCl2时,转移2mol电子,则产生0.1 molCl2时,转移的电子数约为0.2×NA=0.2NA,故答案为:0.2NA.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化、转化电子为解答的关键,侧重分析与应用能力的考查,注意HCl的性质,题目难度不大.


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 6.8 g熔融KHSO4 与3.9 g熔融Na2O2 中阴离子数目相同 | |
| B. | 某金属阳离子的结构示意图为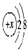 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 | |
| C. | 二硫化碳与二氧化碳结构相似,其电子式为 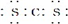 | |
| D. | 中子数为18的氯原子可表示为18Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH | B. | CH3CH3 | C. | CH3CH2OH | D. | CH3OCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若Y的原子序数为m,X的原子序数一定是m±6 | |
| B. | X、Y可以属于同一周期,也可以属于不同周期 | |
| C. | X与Y一定不属于同一主族 | |
| D. | XY一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
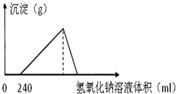 将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:
将5.1g的氧化铝溶于一定浓度的500mL的盐酸中,充分反应后,再逐滴加入0.5mol/L的氢氧化钠溶液,反应过程中生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示,试计算:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | E 元素处于元素周期表中第3 周期第ⅦA 族 | |
| B. | 元素A、B、C 的原子半径:C>B>A | |
| C. | 元素B、C、D 的非金属性:C>B>D | |
| D. | 一定条件下,A 单质可以将D 单质从其氧化物中置换出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以确定该有机物的相对分子量为90 | |
| B. | 可以确定该有机物的分子式为C4H10O2 | |
| C. | 该有机物中碳、氢、原子个数比为2:5:1 | |
| D. | 因为不知道其相对分子量,故无法确定其分子式 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有一透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:
有一透明强酸性溶液,可能含K+、NH4+、Al3+、Cu2+、Fe2+、SO42-、SiO32-、CO32-、NO3-等离子中的若干种,现做如下实验:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com