
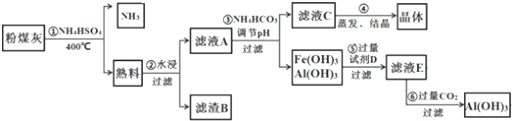
分析 粉煤灰中含有SiO2、Al2O3、Fe2O3等,加入硫酸氢铵加热反应,得到熟料中含有可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,用水浸后,滤液A中含有NH4Fe(SO4)2、NH4Al(SO4)2,滤渣B为SiO2,在滤液A中加入碳酸氢铵调节pH可生成Fe(OH)3、Al(OH)3沉淀,滤液C含有(NH4)2SO4,经蒸发结晶得到(NH4)2SO4晶体,Fe(OH)3、Al(OH)3沉淀加入过量氢氧化钠溶液,得到E为NaAlO2,通入二氧化碳,可生成氢氧化铝沉淀,
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀;
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH-=SiO32-+H2O;
(3)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,此时c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8;在酸性溶液中,H++HCO3-=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4.
解答 解:粉煤灰中含有SiO2、Al2O3、Fe2O3等,加入硫酸氢铵加热反应,得到熟料中含有可溶性的成分主要是NH4Fe(SO4)2、NH4Al(SO4)2等,用水浸后,滤液A中含有NH4Fe(SO4)2、NH4Al(SO4)2,滤渣B为SiO2,在滤液A中加入碳酸氢铵调节pH可生成Fe(OH)3、Al(OH)3沉淀,滤液C含有(NH4)2SO4,经蒸发结晶得到(NH4)2SO4晶体,Fe(OH)3、Al(OH)3沉淀加入过量氢氧化钠溶液,得到E为NaAlO2,通入二氧化碳,可生成氢氧化铝沉淀.
(1)根据题意,Fe2O3与NH4HSO4反应生成 NH4Fe(SO4)2和氨气与水;在NH4Al(SO4)2溶液中加入Ba(OH)2溶液使硫酸根离子恰好完全沉淀,则还会生成氨水和氢氧化铝沉淀,反应的离子方程式为2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+NH3•H2O+Al(OH)3↓,
故答案为:Fe2O3+4NH4HSO4$\frac{\underline{\;400℃\;}}{\;}$2 NH4Fe(SO4)2+2NH3↑+3H2O;2Ba2++4OH-+NH4++Al3++2SO42-=2BaSO4↓+NH3•H2O+Al(OH)3↓;
(2)SiO2不溶于一般酸性溶液,不溶于氨水;SiO2与NaOH溶液反应的离子方程式为SiO2+2OH-=SiO32-+H2O,
故答案为:SiO2、SiO2+2OH-=SiO32-+H2O;
(3)根据KSP[Al(OH)3]=1×10-33;c(Al3+)均小于或等于1×10-9 mol•L-1可认为完全沉淀,c(OH-)=$\root{3}{\frac{1×1{0}^{-33}}{1×1{0}^{-9}}}$=1×10-8;在酸性溶液中发生H++HCO3-=H2O+CO2↑,
故答案为:6;H++HCO3-=H2O+CO2↑;
(4)实验室进行第④步操作时,滤液C得到硫酸铵,所需的仪器是酒精灯、石棉网、三脚架、玻璃棒、蒸发皿;第⑤步所加试剂NaOH,生成四羟基合硫酸根离子,第⑥步生成Al(OH)3的离子方程式为通入CO2,酸碱中和生成(NH4)2SO4,
故答案为:玻璃棒;蒸发皿;(NH4)2SO4;NaOH溶液;[Al(OH)4]-+CO2+H2O=Al(OH)3↓+HCO3-.
点评 本题考查了物质制备实验化工分析判断,物质性质的理解应用,离子方程式、化学方程式书写方法,盐类水解分析应用,掌握基础是关键,题目难度中等.


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁片与稀硫酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ;含极性共价键的分子的中心原子轨道杂化类型sp;
;含极性共价键的分子的中心原子轨道杂化类型sp;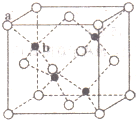
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的钠在等物质的量的Cl2和O2中分别燃烧转移电子数 | |
| B. | 等物质的量的KO2与CaO2分别与水反应生成O2的体积(相同条件下) | |
| C. | 100mL 1mol/L HNO3分别与1.4g Fe、2.8gFe完全反应时生成 的NO物质的量 | |
| D. | 等浓度等体积的盐酸、NaOH溶液分别与一定量Al反应生成等质量气体时转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:1 | C. | 2:1 | D. | 3:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 $\stackrel{Fe/HCl}{→}$
$\stackrel{Fe/HCl}{→}$ 
 (R为-CH3或-H)
(R为-CH3或-H) $\stackrel{MnO_{2}/H_{2}SO_{4}}{→}$
$\stackrel{MnO_{2}/H_{2}SO_{4}}{→}$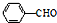
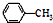 生成A的反应类型是取代反应.
生成A的反应类型是取代反应.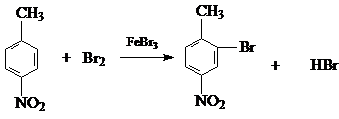 .
.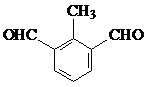 或
或 (任写一种即可)
(任写一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的结构简式:C2H2 | B. | CH4的球棍模型: | ||
| C. | S2-的结构示意图: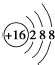 | D. | 乙烯的结构简式:CH2=CH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com