
| A. | Na2O与Na2O2均可与盐酸反应,故二者皆为碱性氧化物 | |
| B. | Na2O与Na2O2不可以相互转化 | |
| C. | 取一块金属钠放在燃烧匙里加热,金属先熔化,燃烧时火焰呈黄色,生成淡黄色固体 | |
| D. | 在呼吸面具中,Na2O2常作供氧剂,而Na2O不能 |
分析 A、和酸反应生成盐和水的氧化物为碱性氧化物,发生的反应为非氧化还原反应;
B、氧化钠和氧气发生反应生成过氧化钠;
C、依据钠的熔点低,灼烧时产生的焰色,以及过氧化钠的颜色解答;
D、在呼吸面具中,Na2O2与CO2发生化合生成Na2CO3和氧气常作供氧剂,而Na2O与CO2发生化合只生成Na2CO3;
解答 解:A、Na2O与Na2O2均可与盐酸反应,氧化钠和酸反应生成氯化钠和水为碱性氧化物,过氧化钠和酸反应生成氯化钠、水和氧气,不是碱性氧化物,故A错误;
B、Na2O与Na2O2可以相互转化,氧化钠和氧气反应生成过氧化钠,故B错误;
C、钠的熔点低,加热易熔化,灼烧时产生黄色的焰色,与空气中的氧气反应生成淡黄色的过氧化钠,故C正确;
D、在呼吸面具中,Na2O2与CO2发生化合生成Na2CO3和氧气常作供氧剂,而Na2O与CO2发生化合只生成Na2CO3,故D正确;
故选CD.
点评 本题考查钠的重要化合物知识,为高频考点,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意把握氧化钠、过氧化钠、钠及其性质的特点,学习中注意相关基础知识的积累,难度不大.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:1 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用广泛pH试纸测氯水的pH=4 | |
| B. | 欲配制1L,1mol/L的NaCl溶液,可将58.5gNaCl溶于1 L水中 | |
| C. | 配制溶液定容时,仰视容量瓶刻度会使所配溶液浓度偏低 | |
| D. | 用瓷坩埚加热熔化氢氧化钠固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | 只有②③ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
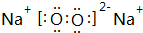 ;
; ,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.
,其原子核外有7个运动状态不同的电子,能量最高的电子为2p轨道上的电子,其轨道呈哑铃形.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com