
【题目】如图所示,隔板I固定不动,活塞II可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
xC(g),向M、N中通入1mol和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是( )
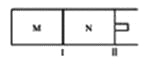
A. 若x=3,达到平衡后A的体积分数关系为:![]()
B. 若x<3,C的平衡浓度关系为:c(M)<c(N)
C. 若x>3,达到平衡后B的转化率关系为:![]()
D. x不论为何值,平衡时M、N中的平均相对分子质量都相等
【答案】B
【解析】试题分析:M容器是恒温恒容下建立的平衡,N容器是恒温恒压下建立的平衡。A.若x=3,由于反应前后气体体积不变,N容器建立的平衡与恒温恒容下建立的平衡等效,所以达到平衡后A的体积分数关系为:φ(M)=φ(N),故A错误;B.若x<3,由于反应后气体体积减小,N容器建立的平衡相当于恒温恒容下建立的平衡缩小容器体积,压强增大,平衡正向移动,C的平衡浓度增大,所以C的平衡浓度关系为:c(M)<c(N),故B正确;C.若x>3,由于反应后气体体积增大,N容器建立的平衡相当于恒温恒容下建立的平衡扩大容器体积,压强减小,平衡正向移动,B的转化率增大,所以达到平衡后B的转化率关系为:α(M)<α(N),故C错误;D.若x=3,M、N中平衡状态相同,平衡时M、N中的平均相对分子质量都相等,若x>3或<3,两者的平衡状态不同,平衡时M、N中的平均相对分子质量不等,故D错误;故选B。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】我国科学家研制了一种新型的高比能量锌碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。
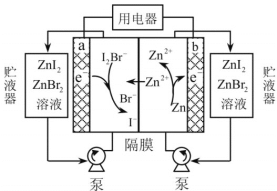
下列叙述不正确的是( )
A.放电时,a电极反应为I2Br-+2e- =2I-+ Br-
B.放电时,溶液中离子的数目增大
C.充电时,b电极每减少0.65g,溶液中有0.02mol I-- 被氧化
D.充电时,a电极接外电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语中,正确的是
A. 氯化氢分子的形成过程可用电子式表示为:![]()
B. 16O与 18O的中子数和核外电子排布均不同
C. 稳定性:CH4>SiH4;还原性:HCl>H2S
D. K+、Ca2+、Mg2+的离子半径依次减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物乙醇,俗名酒精,它易溶于水并有特殊香味,能进行如图所示的多种反应。
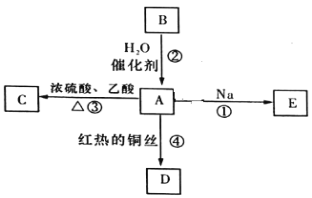
(1)写出D的分子式_____________________。
(2)发生反应①时钠在____________________。(填“液面上”或“液体底部”)。
(3)写出反应③的反应类型___________。
(4)下列关于化合物B的化学性质,说法正确的是__________(填字母)。
A.化合物B可以与Cl2发生取代反应
B.化合物B可以与Cl2发生加成反应
C.化合物B可以使溴的四氯化碳溶液褪色
D.化合物B不可以使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol共价键所吸收的能量或形成1 mol共价键所释放的能量称为键能。已知:H—H键能为436 kJ/mol,H—N键能为391 kJ/mol,N2 (g)+ 3H2(g) ![]() 2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
2NH3(g) ΔH=92.4 kJ/mol,下列说法中正确的是( )
A.H—H比N≡N更牢固
B.N≡N键能约为945.6 kJ/mol
C.合成氨反应选择适当的催化剂是为了提高H2的转化率
D.0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
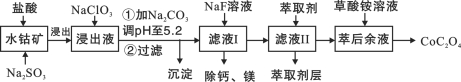
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)请用平衡移动原理分析加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是:________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。

滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径,由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
CH3OH(g)+H2O(g) △H1=-49.58kJ/mol
反应Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ/mol
CH3OH(g) △H3=-90.77kJ/mol
回答下列问题:
(1)反应Ⅱ的△H2=______ ,反应 I自发进行条件是 ______(填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3 L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。

①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3 mol,n(CO2)=1.5 mol B:n(H2)=3 mol,n(CO2)=2 mol,
曲线 I代表哪种投入方式______(用A、B表示)。
②在温度为500K的条件下,按照A方式充入3 molH2和1.5 molCO2,该反应10 min时达到平衡:
a.此温度下的平衡常数为______;500K时,若在此容器中开始充入0.3 mol H2和0.9 molCO2、0.6 mol CH3OH、x mol H2O,若使反应在开始时正向进行,则x应满足的条件是 ______。
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3 min时,迅速将体系温度升至600 K,请在图2中画出3~10 min内容器中CH3OH浓度的变化趋势曲线__________。

(3)化物燃料电池是一种新型的燃料电池,它是以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图3所示,其中多孔电极均不参与电极反应,图3是甲醇燃料电池的模型。
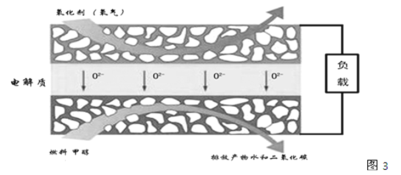
①写出该燃料电池的负极反应式 ______。
②如果用该电池作为电解装置,当有16 g甲醇发生反应时,则理论上提供的电量最多为 ______(法拉第常数为9.65×104C/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新华社报道:全国农村应当在“绿色生态·美丽多彩·低碳节能·循环发展”的理念引导下,更快更好地发展“中国绿色村庄”,参与“亚太国际低碳农庄”建设。可见“低碳循环”已经引起了国民的重视,试回答下列问题:
(1)煤的气化和液化可以提高燃料的利用率。
已知25℃、101kPa时:
①C(s)+![]() O2(g)=CO(g) ΔH=-126.4kJ/mol
O2(g)=CO(g) ΔH=-126.4kJ/mol
②2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
③H2O(g)=H2O(l) ΔH=-44kJ/mol
则在25℃、101kPa时:
C(s)+H2O(g)=CO(g)+H2(g) ΔH=_____。
(2)高炉炼铁是CO气体的重要用途之一,其基本反应为:FeO(s)+CO(g)![]() Fe(s)+CO2(g) ΔH>0
Fe(s)+CO2(g) ΔH>0
已知在1100℃时,该反应的化学平衡常数K=0.263。
①温度升高,化学平衡移动后达到新的平衡,此时平衡常数K值____(填“增大”“减小”或“不变”)。
②1100℃时测得高炉中,c(CO2)=0.025mol/L,c(CO)=0.1mol/L,则在这种情况下,该反应是否处于化学平衡状态?____(填“是”或“否”),其判断依据是___。
(3)目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
CH3OH(g)+H2O(g) ΔH=-49.0kJ/mol。
现向体积为1L的恒容密闭容器中,充入1molCO2和3molH2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示。

①从反应开始到平衡,氢气的平均反应速率v(H2)=____。
②下列措施能使![]() 增大的是____(填字母)。
增大的是____(填字母)。
A.升高温度
B.再充入H2
C.再充入CO2
D.将H2O(g)从体系中分离
E.充入He(g),使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关醋酸溶液的叙述中不正确的是
A.pH =4.3的CH3COOH与CH3COONa混合溶液中:c(Na+) < c(CH3COO-)
B.浓度为0.2 mol/L的CH3COOH溶液和浓度为0.1 mol/L的NaOH溶液等体积混合后:c(CH3COO-) - c(CH3COOH) = 2[c(H+) - c(OH-)]
C.醋酸浓溶液加少量水稀释, 几乎不变
几乎不变
D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+) = 2[c(HC2O4-) + c(C2O42-) + c(H2C2O4)]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com