
PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L, 极性为零,P—Cl键长为204pm和211pm两种。继续加热到250℃时测得压力为计算值的两倍。PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P—Cl的键长为198pm和206pm两种。(P、Cl相对原子质量为31.0、35.5)回答如下问题:(1)180℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。(2)在250℃下PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。(3)PCl5熔体为什么能导电?用最简洁的方式作出解释。(4) PBr5气态分子结构与PCl5相似,它的熔体也能导电,但经测定其中只存在一种P-Br键长。PBr5熔体为什么导电?用最简洁的形式作出解释。
(1)9.5×22.4=208.3g/mol (1分)
PCl5相对分子质量31.0+35.5×5=208.5 (1分)
蒸气组成为PCl5 (1分)
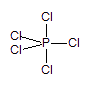
呈三角双锥体。
三角双锥分子无极性,有两种键长。
(2分)
(注:若答成四方锥体不给分,
因它有极性,与题面给的信息不符)
PCl5 = PCl3 + Cl2
氯分子 Cl-Cl 三氯化磷分子 (本小题共3分)
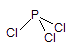
(压力为计算值的两倍表明1mol PCl5完全
分解成1molPCl3和1mol Cl2, 共2mol。
气体由等摩PCl3和Cl2组成。)
(3) PCl5 = PCl4+ + PCl6–
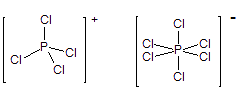 (本小题共3分)
(本小题共3分)
(注:含PCl4+ 和PCl6—两种离子,前者为四面体,后者为八面体,
因此前者只有一种键长,后者也只有一种键长,加起来有两种键长。)
(4) PBr5 = PBr4+ + Br – PBr4+ 结构同PCl4+ (本小题共2分)
(其他答案只要正确也可得分,但适当扣分。)
本题是四个虽相关却又相互独立的问题。问题(1)只涉及第一句话给出的信息。由折合成标准状态的蒸气密度和五氯化磷的化学式量,经过属于中学教学内容的简单的计算,就可以得出:180℃下的PCl5是单体,即PCl5就是它的分子式。PCl5分子有5个Cl原子围绕着P原子排列,信息表明其中有两种不同键长的P-Cl键,可见不可能是平面的五角形的分子(它的磷氧键是一种),一定具有三维立体结构;三维立体结构还可能有两种:三角双锥或者四角锥体,后者的极性不等于零,所以PCl5分子是三角双锥型分子。问题(2)的相关信息是第二句话给出的。该信息无疑表明,PCl5分子在加热到250℃时分解了,生成等量/摩尔的两种气态分子。这种分解反应从类型上说,有的学生可能是熟悉的,例如氧化铜分解生成氧化亚铜和氧气,二氧化锰分解生成四氧化三锰和氧气,三氧化硫分解生成二氧化硫和氧气等等。本题是将这种知识迁移到氯化物上来。所以,可以想见,五氯化磷的分解产物是三氯化磷和氯气。如果答不上来,也不会影响解答后面的问题,这叫做东方不亮西方亮,即便受点挫折,也要经受考验,本题在设计时有这种心理素质考验,因而对第二问的信息提供得较少。问题(3)涉及的是电解质的基本概念:电解质的定义之一是它的熔体能够导电。但是中学课本里对熔体的导电粒子的讨论很少。本问题首先给出PCl5熔体能导电的信息,由这个信息应当想见其中有正、负两种离子存在。那么,是哪两种离子呢?本题的信息是该熔体中有两种不同的P-Cl键长,这就排除了一种是Cl–另一种是PCl4+的可能,因为四配位的PCl4+无论如何不会有两种不同的键长(不管它是正四面体型还是平面四边形),所以两种离子可能是PCl4+和PCl6–。这个小题在表述中避免了画出结构式之类的用语,是为减少暗示。问题(4)是对问题(3)的一个反馈性的暗示。意思无非是说,若将氯改换成溴,与PCl6–相似的PBr6–是不能形成的,因而其中的阴离子只是氯离子。如果学生脑中浮现溴离子比氯离子大得多的图象,就会想象,6个溴离子包在半径很小的P5+外面可能实在太挤了,挤不下了,而较小的氯离子则是有可能的。学化学比起学物理需要有更多的想象力,而想象是创新所不可缺少的思维形式,这或许是化学吸引一大批有志为人类进步、社会发展、祖国昌盛作出一番贡献的人的缘故之一。本题有意进行这样的引导。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
| A、氧化钠是一种白色固体 | B、过氧化钠与水反应放出氢气 | C、烧碱和纯碱进行焰色反应,火焰都呈黄色 | D、往碳酸氢钠溶液中加入氢氧化钠溶液可以转化为碳酸钠 |
查看答案和解析>>
科目:高中化学 来源:三点一测丛书 高中化学 必修2 (江苏版课标本) 江苏版课标本 题型:043
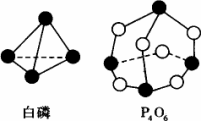
化学反应可视为旧键断裂和新键形成的过程,化学键的键能是形成(或拆开)1 mol化学键时释放出(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1)P-P:198 P-O:360 O-O:498计算反应P4(白磷)+3O2→P4O6的反应热为________.
PCl5也是一种白色固体,加热到160℃不经过液态阶段就变为蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3 g·L-1,继续加热到250℃时测得压力为计算值的两倍.PCl5在加压下于148℃液化,形成一种能导电的液体,测得P-Cl的键长为198 pm和206 pm两种.根据以上条件回答下列问题:
(1)PCl5固体是一种什么类型的晶体?180℃下PCl5蒸气中存在什么分子?为什么?
(2)250℃下PCl5蒸气中存在什么分子?为什么?
(3)PCl5熔体为什么导电?用最简洁的形式作出解释?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在
(2)在
(3)PCl5是共价型分子化合物,熔融时为什么能导电?解释有两种P—Cl键键长的原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com