
在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)  xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是
xC(g) △H>0,其它条件不变,只有温度改变时,某量随温度变化关系如图。则下列说法中错误的是
A.纵坐标可能表示C的产率
B.纵坐标一定可以表示混合气体平均摩尔质量
C.若p1>p2,则x=1或2
D.x的取值与p1、p2的相对大小有关
科目:高中化学 来源: 题型:
某反应过程能量变化如图所示,下列说法正确的是(双选)( )
A.反应过程a有催化剂参与
B.该反应为放热反应,热效应等于ΔH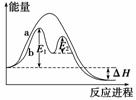
C.改变催化剂,可改变该反应的活化能
D.有催化剂的条件下,反应的活化能等于E1+E2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在指定溶液中能大量共存的是 ( )
A.在含有大量 Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在加入铝粉能产生氢气的溶液中:NH4+、 Fe2+、SO42-、NO3-
C.能使红色石蕊试纸变蓝的溶液中:Na+、K+、CO32-、NO3-、AlO2-
D.能使碘化钾淀粉试纸变蓝的溶液中: Na+、NH4+、S2-、Br-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机反应类型的归属正确的是
①乙烷与Cl2反应制氯乙烷 ②丙烯与Cl2反应制3-氯-1-丙烯 ③苯制环己烷 ④乙炔使酸性KMnO4溶液褪色 ⑤乙烯制聚乙烯 ⑥甲苯燃烧aa
A.①②属于取代反应 B.②③属于加成反应
C.④⑤属于氧化反应 D.⑤⑥属于聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组构想将汽车尾气(NO、NO2)转化为重要的化工原料HNO3,其原理如图所示,其中A、B为多孔材料。下列说法正确的是
A.电极A表面反应之一为NO2-e-+H2O==NO3-+2H+
B.电极B附近的c(NO3-)增大
C.电解质溶液中电流的方向由B到A,电子的流向与之相反
D.该电池工作时,每转移4 mol电子,生成22.4 L O2
查看答案和解析>>
科目:高中化学 来源: 题型:
乙炔是有机合成工业的一种重要原料。工业上曾用CaC2与水反应生成乙炔。
⑴CaC2中C22-与O22+互为等电子体,O22+的电子式可表示为 ,1mol O22+中含有的π键数目为 。
⑵将乙炔通入[Cu(NH3)2]Cl溶液中生成红棕色沉淀Cu2C2。Cu+简写的核外电子排布式为 。
⑶乙炔与HCN反应可得到丙烯腈(CH2=CH—C≡N), 丙烯腈分子中碳原子轨道的杂化类型是 ;分子中处于同一直线上原子数目最多有 个。
⑷CaC2晶体的晶胞结构与NaCl晶体相似(如图所示),但CaC2晶体中哑铃形的C22-的存在,使晶胞沿一个方向拉长, CaC2晶体中一个Ca2+周围距离最近的C22-数目为 。

查看答案和解析>>
科目:高中化学 来源: 题型:
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.pH=1的溶液中:Na+、K+、MnO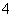 、CO
、CO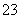
B.c(H+)=1×10-13 mol·L-1的溶液中:Mg2+、Cu2+、SO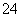 、NO
、NO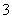
C.0.1 mol·L-1 NH4HCO3溶液中:K+、Na+、NO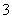 、Cl-
、Cl-
D.0.1 mol·L-1 FeCl3溶液中:Fe2+、NH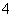 、SCN-、SO
、SCN-、SO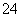
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究NH4HCO3和NaOH的反应,设计实验方案如下:
含0.1 mol NH4HCO3的溶液中加入0.1 mol NaOH,反应完全后,滴加氯化钙稀溶液。
若有沉淀,则NH4HCO3与NaOH的反应可能为____________________________________
(写离子方程式);
若无沉淀,则NH4HCO3与NaOH的反应可能为_____________________________________
(写离子方程式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
将6 g CH3COOH溶于水制得1 L溶液,此溶液的物质的量浓度为________________,经测定溶液中[CH3COO-]为1.4×10-3 mol·L-1,此温度下醋酸的电离常数:Ka=______________,温度升高Ka将________(填“变大”、“变小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com