
【题目】五氟化碘(IF5)是重要的卤氟化物,IF5可与水反应IF5+3H2O=HIO3+5HF,生成的HIO3 与KI在酸性下生成游离碘IO3-+5I-+6H+=3I2+3H2O。用标准硫代硫酸钠溶液滴定碘发生反应2Na2S2O3+I2=Na2S4O6+2NaI即可分析IF5含量,若己知滴定耗用硫代硫酸钠的物质的量为0.3mol,则分析的试样中IF5的物质的量为
A. 0.05mol B. 0.2mol C. 0.lmol D. 0.3mol
科目:高中化学 来源: 题型:
【题目】下列实验方案、现象、得出的结论均正确的是
选项 | 实验及现象 | 结论 |
A | 向SiO2固体加入过量盐酸振荡,固体不溶解 | SiO2不溶于任何酸 |
B | 用玻璃棒蘸取某样品进行焰色反应时观察到黄色火焰 | 该样品含钠元素 |
C | 向酸化的KMnO4溶液通入SO2,向反应后的溶液中加入BaCl2产生白色沉淀 | 白色沉淀为BaSO3 |
D | 将镁条点燃,迅速伸入集满CO2的集气瓶有白色固体和黑色颗粒产生 | CO2具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L氦气与lmol氢气所含原子数均为NA
B. 1L0.l mol/LNaHCO3溶液中含有 0.1NA个 HCO3-
C. 己知可将0.lmolNaCl溶于乙醇中制成胶体,其中含有的胶体粒子数目为0.1NA
D. 6molCl2通入足量热 NaOH 溶液发生反应:3Cl2+6NaOH![]() NaC1O3+5NaCl+3H2O,转移电子数目为10NA
NaC1O3+5NaCl+3H2O,转移电子数目为10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ聚氯乙烯(PVC)保鲜膜的安全问题引起广泛关注。PVC的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。工业上用乙烯和氯气为原料经下列各步合成PVC:
![]()
(1)乙是PVC的单体,其结构简式为_________________________________;
(2)反应①的化学方程式为_________________________________________________;
(3)写出以下反应类型:反应②___________________;反应③_____________________。
II写出下列物质的结构简式或系统命名:
(1)2,4,6—三甲基辛烷__________________________________________________;
(2)3—甲基—1—丁炔 ____________________________________________________;
(3)间甲乙苯_________________________________________________________;
(4)苯乙烯_________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi + LiV3O8 = Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知: LiCl-KCl共晶盐熔点352℃。下列说法正确的是

A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时正极反应为:Li1+xV3O8–xe=LiV3O8+xLi+
C. 放电时Cl 移向LiV3O8电极
D. Li-Si合金熔点高于352℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制取七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:

下列说法不正确的是
A. 溶液1中的阳离子可与NH4+、HCO3-、I-、SO42-在同一溶液中大量共存
B. 向溶液2中加入3-5滴K3[Fe(CN)6](铁氰化钾)溶液,可观察到有蓝色沉淀生成
C. 向固体2中加入足量NaOH溶液,发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O
D. 从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入(或滴入)Y溶液中,其生成沉淀的物质的量与加入X的物质的量关系如图所示,符合图示情况的是( )
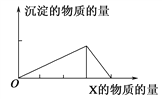
A | B | C | D | |
X | NaOH | HCl | CO2 | AlCl3 |
Y | AlCl3 | NaAlO2 | Ca(OH)2 | NaOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。实验室采用镁屑与液溴为原料制备无水MgBr2,装置如图,主要步骤如下:
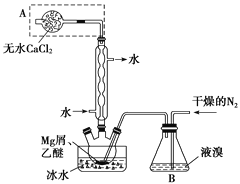
步骤1 三颈瓶中装入10 g镁屑和150 mL无水乙醚;装置B中加入15 mL液溴。
步骤2 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中。
步骤3 反应完毕后恢复至常温,过滤,滤液转移至另一干燥的烧瓶中,冷却至0 ℃,析出晶体,再过滤得三乙醚合溴化镁粗品。
步骤4 室温下用苯溶解粗品,冷却至0 ℃,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至160 ℃分解得无水MgBr2产品。
已知:
①Mg与Br2反应剧烈放热;MgBr2具有强吸水性;
②MgBr2+3C2H5OC2H5![]() MgBr2·3C2H5OC2H5。
MgBr2·3C2H5OC2H5。
请回答:
(1)仪器A的名称是________。实验中不能用干燥空气代替干燥N2,原因是__________。
(2)如将装置B改为装置C(如图),可能会导致的后果是______________________。
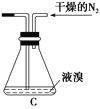
(3)步骤3中,第一次过滤除去的物质是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com