
| c 酸V酸 |
| V碱 |
| 4.0g |
| 5.0g |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| A、78Se和80Se互为同素异形体 |
| B、78Se和80Se互为同位素 |
| C、78Se和80Se分别含有34个中子和46个质子 |
| D、78Se和80Se的化学性质不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:
水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.请回答下列问题:| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| (1)B2H4 |
| (2)H2O/OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、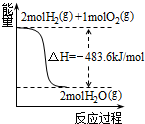 可得H2的燃烧热为483.6kJ?mol-1 |
B、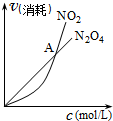 表示恒温恒容条件下发生的可逆反应2NO2(g)═N2O4(g),各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态 |
C、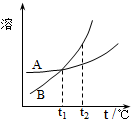 表示A、B两物质的溶解度随温度的变化情况,将t1℃时的A、B饱和溶液分别升温至t2℃时,溶质的质量分数B>A |
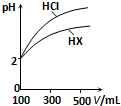
D、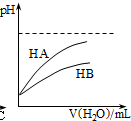 表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加入水量的变化,则常温时同浓度的NaA溶液的pH小于NaB溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

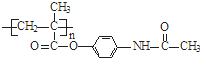
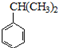 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色;反应②为加成反应
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色;反应②为加成反应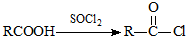
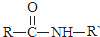
| NaOH溶液 |
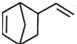 属于芳香烃的同分异构体的同系物制备
属于芳香烃的同分异构体的同系物制备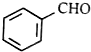 的合成路线,
的合成路线,| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
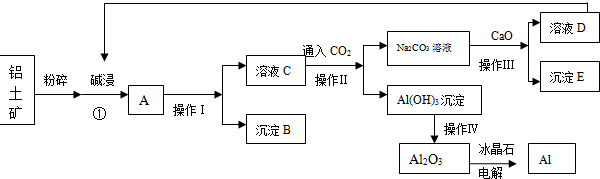
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、热空气能吹出溴是利用溴易挥发的性质 |
| B、SO2吸收溴的反应方程式:SO2+2H2O+Br2→H2SO4+2HBr |
| C、流程中循环利用的物质有SO2、Br2、Cl2等多种 |
| D、没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com