
【题目】过渡元素铁可形成多种配合物,如:[Fe(CN)6]4- 、Fe(SCN)3 等。
(1)基态铁原子核外电子排布式为________________.
(2)科学研究表明用 TiO2 作光催化剂可将废水中 CN- 转化为OCN-,并最终氧化为 N2 、CO2。OCN- 中三种元素的第一电离能由大到小的顺序为_________。
(3)与 CN- 互为等电子体的一种分子为________________(填化学式);1mol Fe(CN)63- 中含有![]() 键的数目为________________。
键的数目为________________。
(4)铁的另一种配合物Fe(CO)5 熔点为 —20.5℃,沸点为 103℃,易溶于CCl4,据此可以判断Fe(CO)5 晶体属于________________(填晶体类型)。
(5)铁铝合金的一种晶体属于体心立方结构,其晶胞可看成由 8 个小体心立方结构堆砌而成。已知小立方体如图所示,该合金的化学式为________________。
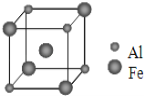
【答案】![]() 或[Ar]3d64s2 N>O>C CO或N2 12×6.02×10-23个或12NA 分子晶体 AlFe3
或[Ar]3d64s2 N>O>C CO或N2 12×6.02×10-23个或12NA 分子晶体 AlFe3
【解析】
(1)铁的原子序数为26,根据能量最低原理其态原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;
(2)同周期第一电离能自左而右具有增大趋势,所以第一电离能O>C.因为氮元素原子2p能级有3个电子,处于半满稳定状态,能量较低,第一电离能大于相邻元素,所以C、N、O三种元素的第一电离能由大到小的顺序是N>O>C;
(3)CN- 有2个原子,价电子数为10,可写出其等电子体为CO或N2,1个CN- 有1个![]() 键, CN- 与铁离子每形成一个配位键会增加一个
键, CN- 与铁离子每形成一个配位键会增加一个![]() 键,则1个Fe(CN)63-中
键,则1个Fe(CN)63-中![]() 键有12个,则1mol Fe(CN)63- 中含有
键有12个,则1mol Fe(CN)63- 中含有![]() 键的数目为12×6.02×10-23个;
键的数目为12×6.02×10-23个;
(4)Fe(CO)5 熔沸点较低,且易溶于有机物,可推测其为分子晶体;
(5)根据铁铝合金晶胞结构铝原子的数目为![]() ;铁原子数目为
;铁原子数目为![]() ,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3。
,所以铝原子与铁原子个数之比为1:3,该铁铝合金的化学式为:AlFe3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用化学方程式表示:盐碱地产生碱性的原因:______________;农业上用石膏降低其碱性的反应原理:__________。
(2)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________(填“>”“<”或“=”)n。
(3)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=__________。
(4)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(![]() )=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
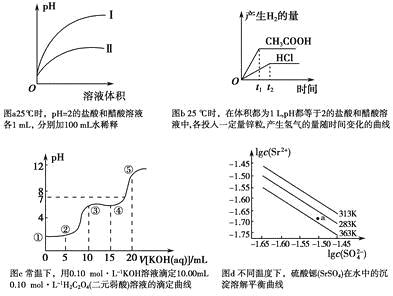
A.图a中,曲线Ⅱ表示醋酸溶液加100 mL水稀释的图像
B.图b中,可能各投入的锌粒颗粒大小相同且质量均为0.65 g
C.图c中,在①、②、③、④、⑤各点的溶液中所含阴离子种类不同
D.图d中,三个不同温度中,313 K时Ksp(SrSO4)最大;且283 K时,图中a点对应的溶液是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素原子的电子层数为n,最外层电子数为2n+1,A、B、C、E每种元素都能与D元素组成两种或两种以上的常见化合物。 回答下列问题:
(1)写出下列各元素符号:C___________ E____________
(2)A和C形成的最简单化合物的电子式为___________,A和D按原子数1:1形成的化合物的结构式为___________。
(3)已知: BA3DA(g)+A2D(g)=BD2(g)+3A2(g) △H= +49.0kJ/mol
BA3DA(g)+1/2D2(g)=BD2(g)+2A2(g) △H = 一192.9kJ/mol
试写出:气态BA3DA完全燃烧生成气态A2D的热化学方程式(用推出的元素符号写,下同)
______________________________________________________________。
利用该燃烧反应设计成的燃料电池正逐步得到推广,请写出该燃料电池负极电极反应式(电解质溶液为KOH):___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述不相符的是( )

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) >Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸>乙酸
C. 图丙用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁可以和CO2发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.下列说法中正确的是
FeO(s)+CO(g)。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.下列说法中正确的是

A. a点为平衡状态
B. b点和c点的化学平衡常数K相同
C. 该反应的化学平衡常数表示为K =[CO]·[FeO]/[CO2]·[Fe]
D. 若温度升高,该反应的化学平衡常数K增大,则该反应的 ΔH < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增,九种短周期元素![]() 用字母表示
用字母表示![]() 原子半径的相对大小、最高正价或最低负价的变化如图所示.
原子半径的相对大小、最高正价或最低负价的变化如图所示.

请回答下列问题;
![]() 、d、e、f四种元素的简单离子中,半径最大的离子是 ______
、d、e、f四种元素的简单离子中,半径最大的离子是 ______ ![]() 填离子符号
填离子符号![]()
![]() 的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
的氢氧化物是一种重要的基本化工原料,写出工业上制备该氢氧化物的离子方程式 ______ 。
![]() 含f元素的两种离子在溶液中不能大量共存的原因是 ______
含f元素的两种离子在溶液中不能大量共存的原因是 ______ ![]() 用离子方程式表示
用离子方程式表示![]()
![]() 关于图乙所示转化关系
关于图乙所示转化关系![]() 代表卤素
代表卤素![]() ,下列说法错误的是 ______ 。
,下列说法错误的是 ______ 。
A.![]()
B.![]()
C.y、z的非金属性依次减弱,所以途径Ⅱ的热量按y、z的顺序依次增多
D.途径Ⅰ生成y的氢化物比生成z的氢化物更容易
![]() 元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:
元素的某种含氧酸是一种新型氧化剂,应用性极强,通过反应:![]() 制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
制得.该反应中水的作用与下列中水的作用相同的是 ______ 。
A.钠与水反应制氢气 ![]() 过氧化钠与水反应制氧气
过氧化钠与水反应制氧气
C.氯气与水反应制次氯酸 ![]() 氟单质与水反应制氧气
氟单质与水反应制氧气
![]() ,f的最高价氧化物的水化物的
,f的最高价氧化物的水化物的![]() ,使含
,使含![]() 的离子的溶液开始产生沉淀的pH为 ______ 。
的离子的溶液开始产生沉淀的pH为 ______ 。
![]() 元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
元素e和g组成的简单化合物B的水溶液中离子浓度由大到小的顺序为 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Fe2+、I-、Br-的混合溶液中通入过量的氯气,溶液中四种粒子的物质的量变化如图所示,已知b-a=5,线段Ⅳ表示一种含氧酸,且Ⅰ和Ⅳ表示的物质中含有相同的元素。下列说法正确的是( )

A.线段Ⅱ表示Br-的变化情况
B.原溶液中n(FeI2):n(FeBr2)=3:1
C.根据图像无法计算a的值
D.线段Ⅳ表示HIO3的变化情况
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com