
A、
| ||
B、
| ||
C、
| ||
D、
|
科目:高中化学 来源: 题型:
| A、在很多反应中IBr是强氧化剂 |
| B、IBr与水反应时既做氧化剂,又做还原剂 |
| C、IBr与AgNO3溶液反应会生成AgBr沉淀 |
| D、IBr与NaOH溶液反应时,生成NaBr和NaIO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、6.4 gS6与S8的混合物中所含S原子数一定为0.2 NA |
| B、1 L 0.1 mol.L-1的醋酸溶液中氢离子数为0.1 NA |
| C、以惰性电极电解NaCl溶液时,每放出11.2LCl2时,则消耗NaCl个数为NA |
| D、在密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移的电子数为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水吸收足量的SO2气体:OH-+SO2=HSO3- |
| B、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| C、用NaOH溶液吸收废气中氮氧化物:NO+NO2+OH-=NO2-+H2O |
| D、向碳酸氢钙溶液中加入少量的氢氧化钠溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
| B、大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
| C、Mg(HCO3)2溶液与过量NaOH:Mg2++2HCO3-+2OH-=MgCO3↓+2H2O+CO32- |
| D、次氯酸钙与亚硫酸:Ca2++2ClO-+H2SO3=CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 4 |
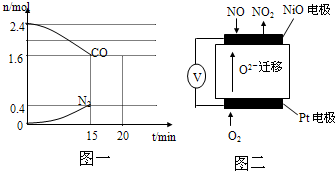
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com