
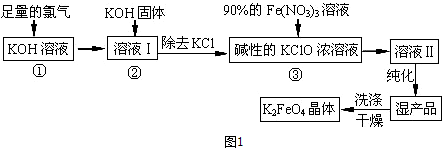
分析 足量Cl2通入和KOH溶液中,温度低时发生反应2KOH+Cl2=KCl+KClO+H2O,向溶液I中加入KOH,使氯气完全反应,且将溶液转化为碱性溶液,只有碱性条件下次氯酸根离子才能和铁离子发生氧化还原反应生成高铁酸根离子,除去KCl得到碱性的KClO浓溶液,向碱性的KClO浓溶液中加入90%的Fe(NO3)3溶液,发生反应2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,得到溶液II,纯化得到湿产品,将湿产品洗涤、干燥得到晶体K2FeO4,
(1)根据常用仪器的用途解答;根据流程,需生成KClO,温度较低时生成KClO;
(2)KOH和氯气在低温下反应生成KClO,只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,再往仪器a中加入浓KOH溶液的目的是与过量的Cl2继续反应,生成更多的KClO,氯气为黄绿色气体,判断浓KOH溶液已过量三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
(3)根据题目信息、氧化还原反应中化合价发生变化确定产物以及电子得失守恒和质量守恒来配平;
(4)①加入饱和KOH溶液可以增大氢氧根离子的浓度,使平衡向左移动;
②只要检验最后一次的洗涤中无Cl-,即可证明K2FeO4晶体已经洗涤干净;
(5)用电解法制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水.
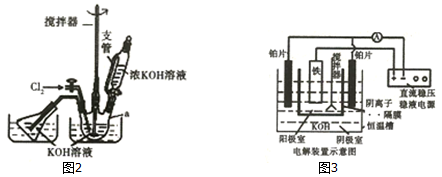
解答 解:(1)恒压滴液漏斗上部和三颈烧瓶气压相通,可以保证恒压滴液漏斗中的液体顺利滴下,根据流程,需生成KClO,2KOH+Cl2=KCl+KClO+H2O(条件:较低温度),所以两水槽中的水为冷水;
故答案为:平衡压强;冷水;
(2)只有碱性条件下,铁离子才能和次氯酸根离子发生氧化还原反应生成高铁酸根离子,KOH和氯气反应生成KClO,所以加入KOH的目的是除去氯气且使溶液为后一步反应提供碱性,氯气为黄绿色气体,判断浓KOH溶液已过量三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
故答案为:与过量的Cl2继续反应,生成更多的KClO;三颈烧瓶内颜色彻底变成无色后,再加适量的浓氢氧化钾;
(3)据题目信息和氧化还原反应中化合价发生变化确定找出反应物:Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒和质量守恒来配平,Fe3+、ClO-,生成物:FeO42-、Cl-,根据电子得失守恒:Fe(+3→+6),Cl(+1→-1),最小公倍数为6,所以Fe3+、FeO42-前系数都为2,ClO-、Cl-,前系数都为3,结合质量守恒和电荷守恒可得2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)①K2FeO4 在水溶液中易水解:4FeO42-+10H2O?4Fe(OH)3(胶体)+8OH-+3O2↑,加入饱和KOH溶液可以增大氢氧根离子的浓度,使平衡向左移动,抑制FeO42-的水解;
故答案为:增大氢氧根离子的浓度,抑制FeO42-的水解;
②K2FeO4晶体表面若含有杂质离子为氯离子,所以只要检验最后一次的洗涤中无Cl-,即可证明晶体已经洗涤干净;
故答案为:用试管取少量最后一次的洗涤液,加入硝酸酸化的硝酸银溶液,若无白色沉淀则已被洗净;
(5)用铁做阳极电解氢氧化钠制备铁酸钠,电解时铁失去电子发生氧化反应结合氢氧根离子生成铁酸跟离子和水,电极反应式为:Fe+8OH--6e-=FeO42-+4H2O;
故答案为:Fe+8OH--6e-═FeO42-+4H2O.
点评 本题考查物质的制备实验,为高频考点,把握流程图中每一步发生的反应及操作方法是解本题关键,注意结合题给信息解答,侧重分析与实验能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 为了防止白色污染应将废旧塑料加以焚烧 | |
| B. | 加热能杀死H7N9禽流感病毒是因为病毒的蛋白质受热变性 | |
| C. | 富脂禽品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3(g)+O2(g)=NO(g)+H2O(g)△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)=6CO2(g)+6H2O(l)△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)=2CO2(g)△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)=CH3CHO(l)+H2O(l)△H=-dkJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子键 | B. | 极性共价键 | C. | 非极性共价键 | D. | 范德华力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
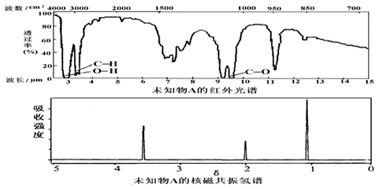
| A. | 由红光外谱可知,该有机物中至少有三种不同的化学键 | |
| B. | 由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子 | |
| C. | 若A的化学式为C3H6O,则其结构简式为CH3COCH3 | |
| D. | 仅由其核磁共振氢谱无法得知其分子中的氢原子总数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )
电-Fenton法是用于水体中有机污染物降解的高级氧化技术,其反应原理如图所示.其中电解产生的H2O2与Fe2+发生Fenton反应:H2O2+Fe2+═Fe3++OH-+•OH,生成的羟基自由基(•OH)能氧化降解有机污染物.下列说法中正确的是( )| A. | 电源的X极为正极,Y极为负极 | |
| B. | 阴极的电极反应式为Fe2+-e-═Fe3+ | |
| C. | 阳极的电极反应式为H2O-e-═H++•OH | |
| D. | 每消耗1 mol O2,整个电解池中理论上可产生2 mol•OH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
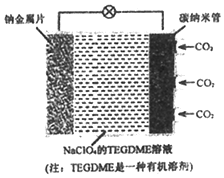 我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )
我国对‘可呼吸”的钠-二氧化碳电池的研究取得突破性进展.该电池的总反应式为:4Na+3CO2 $→_{充电}^{放电℃}$ 2Na2CO3+C,其工作原理如图所示(放电时产生Na2CO3固体储存于碳纳米管中).下列说法不正确的是( )| A. | 放电时,钠金属片作负极,碳纳米管作正极 | |
| B. | 充电时,阳极反应为:2Na2CO3+C-4e-═3CO2↑+4Na+ | |
| C. | 放电时,Na+从负极区向正极区移动 | |
| D. | 该电池的电解质溶液也可使用NaClO4的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A、C的氧化物均含离子键 | |
| B. | C离子的半径小于D离子的半径 | |
| C. | A、B可形成多种原子个数比为1:1的化合物 | |
| D. | 含D元素的盐溶液只能显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com