
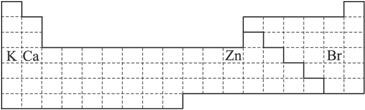
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的________族。
(3)第四周期有A、B、C、D四种元素,其最外层电子数依次为1、2、2、7,其原子序数按A、B、C、D的顺序增大,又已知A、B的次外层电子数为8,C、D的次外层电子数为18。请将A、B、C、D用元素符号填写在上面周期表中的对应位置上。
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
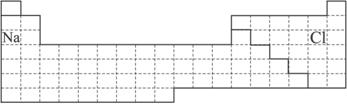
(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可把氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可把氢元素放在周期表中的_________族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应呈黄色。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲元素与硫元素相比较,非金属性较强的是___________(填名称),写出可以验证该结论的一个化学反应方程式_________________________________________________________。
(B)
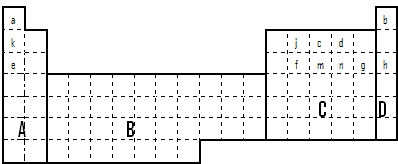
(1)在上面元素周期表中全部是金属元素的区域为_____________。
a.A b.B c.C d.D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是_____________。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是___________(填名称),可以验证该结论的实验是_________________________________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

A.(1)在上面元素周期表中画出金属元素与非金属元素的分界线。
(2)根据NaH的存在,有人提议可将氢元素放在ⅦA族,那么根据其最高正价与最低负价的绝对值相等,又可将氢元素放在周期表中的__________族。
(3)现有甲、乙两种元素,甲元素原子核外3p亚层上有5个电子,乙元素的焰色反应显黄色。
① 用元素符号将甲、乙两元素填写在上面元素周期表中对应位置。
② 甲元素与硫元素相比较,非金属性较强的是__________(填名称),写出可以验证该结论的一个化学反应方程式__________。
B.
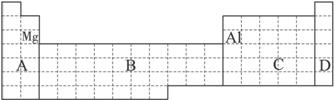
(1)在上面元素周期表中全部是金属元素的区域为__________。
(a)A (b)B (c)C (d)D
(2)有人认为形成化合物最多的元素不是ⅣA族的碳元素,而是另一种短周期元素,请你根据学过的化学知识判断这一元素是__________。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素相比较,金属性较强的是__________(填名称),可以验证该结论的实验是__________。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应?
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com