
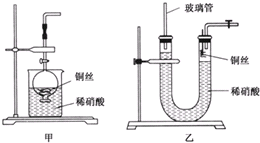
| 浓硝酸 |
| 稀硝酸 |
| 氯气 |
| 硝酸 |
| 空气 |
| 硝酸 |
| ||


科目:高中化学 来源: 题型:
| A、用大理石跟稀盐酸制二氧化碳:CO32-+2H+═H2O+CO2↑ |
| B、Cu丝伸入到AgNO3溶液中:Cu+Ag+═Cu2++Ag |
| C、H2SO4溶液中滴入Ba(OH)2溶液:OH-+H+═H2O |
| D、氧化镁与盐酸混合:MgO+2H+=Mg2++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、42He原子核内含有4个质子 |
| B、32He和42He互为同位素 |
| C、32He原子核内含有3个中子 |
| D、42He容易失去最外层的2电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验结论 |
| ①将混合物溶于水,得到无色透明溶液 | 原混合物肯定无 |
| ②取少量上述溶液两份,其中一份加入BaCl2溶液,立即产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 原混合物肯定有 |
| ③在另一份溶液中加入NaOH溶液,也产生白色沉淀 | 原混合物肯定有 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
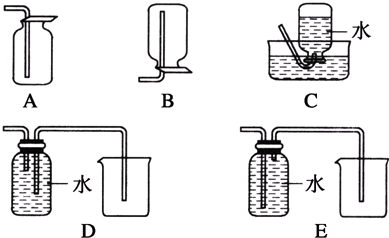
 溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.
溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.某同学依据溴乙烷的性质,用如图实验装置(铁架台、酒精灯略)验证取代反应和消去反应的产物,请你一起参与探究.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,含有石蕊的醋酸溶液加热颜色变深 |
| B、常温下,测得0.1 mol/L醋酸溶液的pH=4 |
| C、常温下,将pH=1的醋酸溶液稀释1 000倍,测得pH<4 |
| D、常温下,将物质的量浓度相同的醋酸溶液与氢氧化钠溶液等体积混合后恰好中和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com