
| A、气体A为SO2和H2的混合物 |
| B、气体A中SO2和H2的体积比为4:1 |
| C、反应中共消耗锌97.5 g |
| D、反应中共转移电子1.5 mol |
| 16.8L |
| 22.4L/mol |
|
|
| 16.8L |
| 22.4L/mol |
|
|
| 0.6mol×(6-4)+0.15×2×(1-0) |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
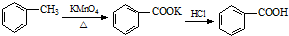
| 名称 | 性状 | 熔点 (℃) | 沸点 (℃) | 密度 (g/mL) | 溶解度(g) | |
| 水 | 乙醇 | |||||
| 甲苯 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | 互溶 |
| 苯甲酸 | 白色片状或针状晶体 | 122.4[1] | 248 | 1.2659 | 微溶[2] | 易溶 |
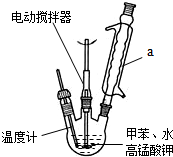 装置a的作用是
装置a的作用是 +
+ +
+查看答案和解析>>
科目:高中化学 来源: 题型:
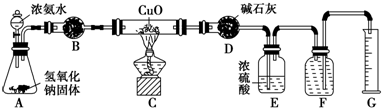 氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:
氨气与灼热的氧化铜反应生成铜、氮气和水.利用如图所示实验装置可测定氨分子的组成(图中夹持、固定装置部分均略去).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO4的溶度积常数比BaCO3的小 |
| B、SO42-没有毒性CO32-有毒性 |
| C、BaSO4密度大 |
| D、胃酸能与CO32-结合,生成CO2和H2O,使BaCO3的沉淀溶解平衡向右移动,使Ba2+浓度增大,造成中毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):
某种胃药的止酸剂为碳酸钙,测定每片中碳酸钙含量的方法有以下几步操作(设药片中的其他成分不与盐酸或氢氧化钠反应):| 测定次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| V/mL | 12.9 | 15.4 | 13.1 | 13.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
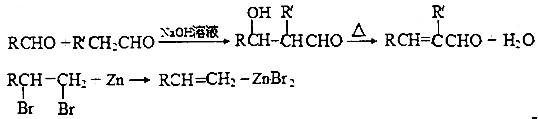
查看答案和解析>>
科目:高中化学 来源: 题型:
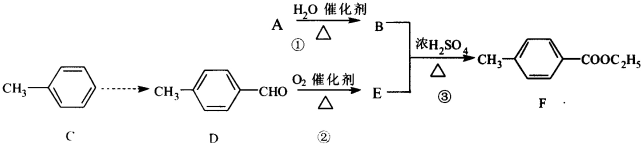
查看答案和解析>>
科目:高中化学 来源: 题型:
A、常温下,NO分解产生O2的反应的平衡常数表达式为K1=
| ||
| B、常温下,水分解产生O2,此时平衡常数的数值约为5×10-80 | ||
| C、常温下,NO、H2O、CO2三种化合物分解放出O2的倾向由大到小的顺序为NO>H2O>CO2 | ||
D、反应2CO(g)+2NO(g)=N2(g)+2CO2(g)的平衡常数K4=
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com