
【题目】通过计算填写下列内容:
(1)2.5mol CH4的质量是____________;标准状况下的体积为_______________。
(2)1.5NA个H3PO4含氧原子的物质的量为_________。
(3)12g某二价金属的硫酸盐中,含有0.1mol SO![]() ,该金属的相对原子质量为________。
,该金属的相对原子质量为________。
(4)实验测得CO、N2和O2等三种气体的混合气体的密度是H2的15.5倍,其中O2的质量分数为___________。
【答案】40g 56L 6mol 24 77.4%
【解析】
(1)根据m=nM、V=nVm进行计算;
(2)根据n=![]() 进行计算;
进行计算;
(3)根据M=![]() 计算硫酸盐的摩尔质量,再根据物质的摩尔质量数值上等于相对分子质量,再求算金属的相对原子质量;
计算硫酸盐的摩尔质量,再根据物质的摩尔质量数值上等于相对分子质量,再求算金属的相对原子质量;
(4)三种气体的平均相对分子质量为15.5×2=31,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑。
(1)2.5mol甲烷的质量m=nM=2.5mol×16g/mol=40g;标况下甲烷体积V=nVm=2.5mol×22.4L/mol=56L;
(2)1.5NA个H3PO4的物质的量n=![]() =
=![]() =1.5mol;每个H3PO4含有4个O原子,故1.5mol H3PO4含氧原子的物质的量为1.5mol×4=6mol;
=1.5mol;每个H3PO4含有4个O原子,故1.5mol H3PO4含氧原子的物质的量为1.5mol×4=6mol;
(3)二价金属的硫酸盐中,金属的物质的量等于硫酸根离子的物质的量等于硫酸盐的物质的量。则:M=![]() =
=![]() =120g/mol,所以金属的相对原子质量为:120-96=24;
=120g/mol,所以金属的相对原子质量为:120-96=24;
(4)三种气体的平均相对分子质量为15.5×2=31,因CO与N2的相对分子质量相同,求算平均相对分子质量时可一并考虑,设O2的物质的量分数为x,则CO和N2的物质的量分数为(1-x),因此有:32x+28(1-x)=31,解得x=0.75。O2的质量分数为![]() ×100%≈77.4%。
×100%≈77.4%。


 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中正确的有
①0.1mol丙烯酸中含有双键的数目为0.1NA
②12g金刚石中,碳碳共价键数为4NA
③常温下,21g C3H6和C4H8的混合物中含有的碳原子数为1.5NA
④2g ![]() 中含有的质子数、中子数、电子数均为NA
中含有的质子数、中子数、电子数均为NA
⑤常温常压下,S2和S6的混合物共6.4g,其中所含硫原子数一定为0.2NA
⑥10mL 18mol/L的浓硫酸与足量的镁反应时转移的电子数为0.18NA
A. ①⑥B. ④⑤⑥C. ③④⑤D. ①②⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl ![]() NH3
NH3![]() +HCl
+HCl![]()
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的有关数据,根据标签上的有关数据回答下列问题:
盐酸
分子式:HCl
相对分子质量:36.5
密度:1.19g/cm3
质量分数:36.5%
(1)该浓盐酸的物质的量浓度是___mol/L。
(2)取用任意体积的浓盐酸时,下列物理量不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制100mL物质的量浓度为2.00mol/L的稀盐酸。
①该学生需要量取___mL(保留一位小数)上述浓盐酸进行配制。
②需要使用的实验仪器有:烧杯、玻璃棒、量筒、__和___。
③配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(在横线上填写“偏大”、“偏小”或“无影响”)
a.用量筒量取浓盐酸时俯视___;
b.向容量瓶中滴加蒸馏水定容时俯视__;
c.转移前,容量瓶中含有少量蒸馏水__。
(4)取所配制的2mol/L的稀盐酸50mL,加入足量的碳酸钙固体,求可以制得标准状况下的CO2气体体积___?若忽略反应过程中的体积变化,求所得溶液中CaCl2的物质的量浓度?(写出解题过程)。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂,常见制备方法如下。
(1)氯酸钾氧化法:化学反应方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KC1+3C12,每生成3mol KH(IO3)2,反应中转移的电子数为______,向反应后溶液中加______溶液得到KIO3。
(2)一种由含碘废水制取碘酸钾的工艺如图:
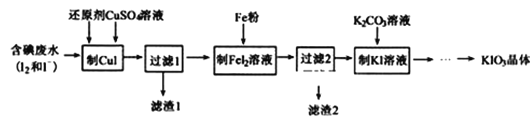
①进行“过滤1”时,需同时对CuI沉淀进行洗涤。在洗涤液中可通过滴加______盐溶液来检验其是否已洗涤干净。
②“制FeI2”时,发生反应的化学方程式为______。
③在KIO3、KHSO3的酸性混合溶液中加入少量KI(催化剂)和淀粉,不停地搅拌,反应机理为:第一步IO3-+5I-+6H+=3I2+3H2O第二步反应的离子方程式为______。
当反应进行到1.5min时,溶液突然变为蓝色,随之又很快消失,则第______步反应速率快。
④改变反应温度,重复上述实验,得到温度(T)与溶液变蓝所需时间(t)的关系如图所示(超过50℃后溶液不会再变蓝)。根据图象,请你分析温度低于50℃时,溶液变蓝所需时间与反应温度的关系:_________。

(3)山东省已下调食用盐碘含量标准每千克盐含碘25毫克(波动范围为18~33mgkg-1)。测定食盐试样中碘元素含量的步骤如下:称取4.000g市售食盐加入锥形瓶中,依次加入适量的水、稍过量KI及稀硫酸;充分反应后,再加入12.00mL6.000×10-4molL-1Na2S2O3溶液,与生成的碘恰好完全反应。有关反应原理为:
KIO3+5KI+3H2SO4=3K2SO4+3I2+3H2O;I2+2S2O32-=2I-+S4O62-。计算该食盐试样中碘元素的含量______mgkg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 若把H2S分子写成H3S分子,违背了共价键的饱和性
B. H3O+离子中存在配位键
C. 已知X、Y元素同周期,且电负性X>Y, 第一电离能X一定大于Y
D. 在面心立方堆积的金属晶体中,属于1个晶胞的金属原子有4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,科学家研发了“全氢电池”,其工作原理如图所示。下列有关该电池工作时的说法,正确的是( )

A. 电解质溶液中,Na+向左移动
B. 该电池的总反应为H+ + OH- = H2O
C. 电子由N电极经导线流向M电极
D. 导线上通过1mole-,装置内H2总量减少0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是MnO2工业制备及对含Mn2+废水处理的有关问题,已知:Ksp[Mn(OH)2]=1.9×10-13 , Ksp(MnCO3)=2.2×10-11,回答下列问题:
(1)用惰性电极电解MnSO4溶液可制备MnO2,其阳极反应式为___________。
(2)往MnSO4溶液中加入(NH4)2CO3溶液制取MnCO3时会产生Mn(OH)2,可能的原因是:MnCO3(s)+2OH-(aq) ![]() Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
Mn(OH)2(s)+CO32-(aq),该反应的平衡常数K=_________(保留一位小数)。
(3)废水中的Mn2+,也可用NH4HSO4调节溶液的pH。室温时,往100 mL 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L NaOH溶液,所得溶液的pH与所加NaOH溶液体积的关系曲线如下图所示 (反应前后溶液总体积变化忽略不计) 。

a点c(NH4+)+c(NH3 .H2O)=__________mol·L-1 ;图中a、b、c、d四个点,水的电离程度最大的是__________;b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写不正确的是
A. 向海带灰浸出液中加入硫酸、双氧水:2I-+2H++H2O2===I2+2H2O
B. 碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-===BaCO3↓+H2O
C. 向Al2(SO4)3溶液中加入过量的氨水:Al3++4NH3·H2O===AlO2-+4NH4++2H2O
D. 用铁棒作阴极,碳棒作阳极电解饱和氯化钠溶液:2Cl-+2H2O![]() H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com