
| 条件改变 | 结论 | |
| A | 平衡后向容器中充入1molHe | 平衡常数不变,混合气体的密度也不变 |
| B | 起始时向容器中充入0.5molSO2、0.25molO2和2molSO3 | 反应达到平衡前v(正)>v(逆) |
| C | 起始时向容器中充入1molSO2和0.5mol O2 | 达到平衡时共放出78.4kJ的热量 |
| D | 起始时向容器中充入1molSO2和0.5molO2 | 达到平衡时,SO2的转化率为60% |
| A、A | B、B | C、C | D、D |
| m |
| V |
| ||||
(
|
| 1 |
| 0.00125 |
| 0.122 |
| 0.082×0.04 |


科目:高中化学 来源: 题型:
| A、用氨水鉴别Al3+、Mg2+和Ag+ |
| B、用Ba(NO3)2溶液鉴别Cl-、SO42-和CO32- |
| C、用水鉴别乙醇、甲苯、硝基苯 |
| D、用KMnO4酸性溶液鉴别苯、甲苯、环己烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解饱和食盐水制烧碱采用离子交换膜法,可以阻止阳离子通过 |
| B、在铁上镀锌时,锌棒作阴极,且电解液硫酸锌的浓度是不变的 |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀醋酸溶液中 |
| B、氢氧化钙悬浊液中 |
| C、二氧化硫与氧气反应的混合物中 |
| D、稀氯化钠水溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 |
B、 |
C、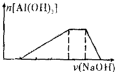 |
D、 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、39:24:13 |
| B、22:7:14 |
| C、13:8:29 |
| D、26:16:57 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.
SiH4(硅烷)法生产高纯多晶硅是非常优异的方法.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2是氧化物,不是碱性氧化物 |
| B、Na2CO3不是碱,是一种钠盐 |
| C、NaOH是一元碱、强碱 |
| D、NaClO是钠盐、含氧酸盐 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com