
分析 某温度下,蒸馏水的pH=6,而蒸馏水显中性,故c(H+)=c(OH-)=10-6mol/L,则Kw=10-12.
当R2+完全沉淀时,c(R2+)小于10-5mol/L,根据Ksp=(R2+)×c2(OH-)计算该题.
解答 解:某温度下,蒸馏水的pH=6,而蒸馏水显中性,故c(H+)=c(OH-)=10-6mol/L,则该温度下的Kw=10-12.
R(OH)2的Ksp=(R2+)×c2(OH-),R2+完全沉淀时,c(R2+)小于10-5mol/L,c(OH-)≥$\sqrt{\frac{1×1{0}^{-13}}{1×1{0}^{-5}}}$=1×10-4mol/L,c(H+)=$\frac{1×1{0}^{-12}}{1×1{0}^{-4}}$mol/L=1×10-8mol/L,pH=8.
故答案为:8.
点评 本题考查难溶电解质的相关计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用即可解答该题,难度不大.


科目:高中化学 来源: 题型:选择题
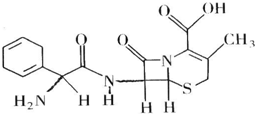 头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )
头孢拉定片(Cefradine Tablets),又称先锋,其结构式如图所示,有关该物质的描述正确的是( )| A. | 分子式为C16H20N3O4S | |
| B. | 该物质在一定条件下能发生水解 | |
| C. | 该有机物质属于芳香族化合物 | |
| D. | 该物质不能与NaHCO3溶液反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
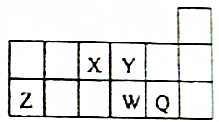 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,下列说法正确的是( )| A. | 元素X的最低化合价绝对值与元素X的最高正化合价之和的数值等于8 | |
| B. | 简单离子半径的大小顺序为:Z3+>W2->Q->Y2- | |
| C. | Y与氢元素形成的化合物中均只含极性共价键 | |
| D. | 最高价的X与Q形成的化合物中,各原子都为8电子稳定结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、CO32- | B. | Ba2+、K+、OH-、NO3- | ||
| C. | H+、Al3+、NH4+、SO42- | D. | Na+、Cl-、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
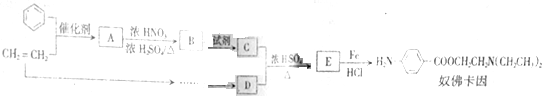
 ,生成A的反应类型为加成反应.
,生成A的反应类型为加成反应.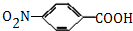 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H2O.
+H2O. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$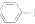
 +H2O
+H2O| 名称 | 相对分子质量 | 性状 | 密度/(g/cm3) | 熔点/℃ | 沸点/℃ | 溶解度 | |
| 苯胺 | 93 | 无色油状液体具有还原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 无色液体 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶体 | 1.22 | 114 | 304 | 微溶于冷水,溶于热水 | |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将10 mL0.1 mol•L-1Na2CO3溶液逐滴滴加到10 mlL0.1 mol•L-1盐酸中,混合溶液中各离子浓度的大小关系:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| B. | 物质的量浓度相等的NaF溶液和CH3COONa溶液相比较,两者离子的总浓度相等 | |
| C. | 向0.1mol•L-1的FeCl3溶液中滴加少量酸性KMnO4溶液,KMnO4溶液不褪色,说明FeCl3只有氧化性,无法被氧化剂氧化 | |
| D. | 将AgCl与AgBr的饱和溶液等体积混合,再加入足量AgNO3浓溶液,可观察到大量淡黄色沉淀与少量白色沉淀,说明Ksp(AgCl)>Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若mXa+与nYb-符合题目要求,则m+a=n-b | |
| B. | 若X的原子半径大于Y,则气态氢化物的稳定性HmX一定小于HnY | |
| C. | X,Y一定不是相邻周期元素 | |
| D. | 若X,Y处于同一周期且X离子所带电荷多于Y离子,则离子半径一定为:X>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com